
| A. | 维生素A: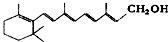 它是一种难溶于水的醇 它是一种难溶于水的醇 | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2 | |
| D. | 金属材料都是导体,非金属材料不都是绝缘体 |
分析 A.含-OH且与脂肪烃基相连为醇,烃基较大,为憎水基;
B.纯毛织物的成分为蛋白质,灼烧有烧焦羽毛的气味;
C.pH值由4.68变为4.28,为酸雨;
D.金属中含自由电子可导电,非金属材料如石墨、Si均导电.
解答 解:A.含-OH且与脂肪烃基相连为醇,烃基较大,为憎水基,则维生素A是一种难溶于水的醇,故A正确;
B.纯毛织物的成分为蛋白质,灼烧有烧焦羽毛的气味,则用灼烧并闻气味的方法区别纯棉织物和纯毛织物,故B正确;
C.pH值由4.68变为4.28,为酸雨,则水中溶解了较多的SO2,故C错误;
D.金属中含自由电子可导电,非金属材料如石墨、Si均导电,大多数非金属不导电,则金属材料都是导体,非金属材料不都是绝缘体,故D正确;
故选C.
点评 本题考查较综合,涉及有机物的鉴别、结构与性质、酸雨及材料等,为高频考点,把握物质的结构、性质、化学与生活的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:多选题
| A. | 1.0 | B. | 1.35 | C. | 1.5 | D. | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3与盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | Al2O3溶于过量NaOH溶液:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 铁溶于稀H2SO4中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Al(OH)3溶于NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Br-、NO3- | B. | K+、NH+4、CO32-、Br- | ||
| C. | Fe2+、Na+、MnO4-、Cl- | D. | Cu2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
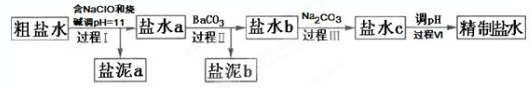
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
| A. | 盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2 | |
| B. | 过程Ⅰ中NH4+转化为N2的离子方程式是3ClO-+2NH4+═3Cl-+N2↑+3H2O+2H+ | |
| C. | 过程Ⅱ中通入CO2有利于除SO42- | |
| D. | 过程Ⅳ调pH可以使用硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com