
| A. | 0.2mol/LNH3.H2O溶液与0.1mol/L盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COOH)>c(CH3COO-) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)=c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L Na2CO3溶液与0.1mol/LNaHSO4溶液等体积混合所得溶液:c(CO32-)+2 c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) |
分析 A.反应后溶质为等浓度的一水合氨和氯化铵,铵根离子的水解程度需要一水合氨的电离程度,溶液呈碱性,则c(OH-)>c(H+);
B.混合液呈酸性,则醋酸的电离程度大于醋酸根离子的水解程度;
C.反应后生成等浓度的硫酸钠、硫酸铵,铵根离子部分水解,溶液呈酸性,则c(H+)>c(OH-)、根据物料守恒可知c(Na+)=c(SO42-)=c(NH4+)+c(NH3•H2O);
D.反应后溶质为等浓度的碳酸氢钠和硫酸钠,碳酸氢根离子的水解程度较小,则c(HCO3-)远远大于c(CO32-)+2c(OH-).
解答 解:A.0.2mol/LNH3•H2O溶液与0.1mol/L盐酸等体积混合,反应后溶质为等浓度的一水合氨和氯化铵,由于一水合氨的电离程度大于铵根离子的水解程度,溶液呈碱性,则c(OH-)>c(H+)、c(NH4+)>c(Cl-),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A错误;
B.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COOH)<c(CH3COO-),故B错误;
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合,根据物料守恒可知:c(Na+)=c(SO42-)=c(NH4+)+c(NH3•H2O),由于铵根离子部分水解,溶液显示酸性,溶液中离子浓度大小为:c (Na+)=c (SO42-)>c(NH4+)>c(H+)>c(OH-),故C正确;
D.0.1mol/L Na2CO3溶液与0.1mol/LNaHSO4溶液等体积混合得到等浓度的碳酸氢钠、硫酸钠,由于碳酸氢根离子的水解程度较小,则c(HCO3-)远远大于c(CO32-)+2c(OH-),所以c(CO32-)+c(OH-)<c(HCO3-)+c(H2CO3)+c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成及盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Fe2O3跟稀硝酸反应 | B. | Al(OH)3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Fe(OH)2跟稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学,使光学显微镜分辨率步入纳米时代.利用此类光学显微镜可以具有丁达尔效应的分散系中分散质 | |
| D. | 酸碱指示剂变色、煤的液化、海水提取溴、焰色反应都涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,钢铁制品和铝制品都容易发生吸氧腐蚀 | |
| B. | 聚乙烯塑料易老化,是因为发生了加成反应 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 空气质量指标中有一项指标名称为PM2.5,指的是空气中直径≤2.5微米的固体或液体的总称 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
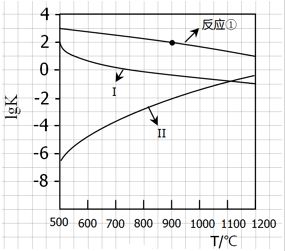 用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
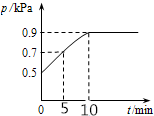 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 该温度下此反应的平衡常数K=0.64mol/L | |
| B. | 从反应开始到t1时的平均反应速率v(X)=0.008mol/(L•min) | |
| C. | 欲提高平衡体系中Y的体积分数,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g钠在氧气中完全燃烧失电子数为0.5NA | |
| B. | 标准状况下,22.4 L苯所含的分子数 | |
| C. | 室温下,8 g甲烷含有共价键数为2NA | |
| D. | 1 L 1 mol•L-1硫酸溶液所含的H+数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com