
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。

(1)实验室用上述装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为:
。
 ②为验证二氧化硫的还原性,充分反应后,取试管b
②为验证二氧化硫的还原性,充分反应后,取试管b
中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= 用含硫微粒浓度的代数式表示)。
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
化学式为C5H12O的有机物,可与金属钠反应产生氢气,试根据下列性质按要求填空。
(1)若该有机物可去氢被氧化成羰基化合物,而不能发生脱水消去反应,则该有机物
可能氧化生成的羰基化合物的结构简式为 。
名称
(2)若该有机物不能去氢被氧化成羰基化合物,而能发生脱水消去反应,则该有机物
的结构简式可能为 。
名称
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NH4CuSO3与足量的10mol/L硫酸混合微热,产生下列现象:
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色
据此判断下列说法正确的是( )
A.反应中硫酸作氧化剂 B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气 D.1mol NH4CuSO3完全反应转移0.5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I的阳离子是由第三周期元素形成的简单离子中半径最小的,E是红褐色物质,K是红棕色物质。反应⑩为少量J的溶液与足量G的反应。
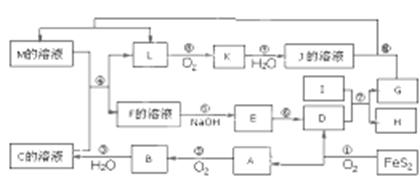
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_________族
(2)写出反应②的化学方程式
(3)写出反应④的离子方程式_______________________________________
(4)主族元素X与I某些性质相似,X的各层电子数相等。写出X与短周期原子半径最大元素的最高价氧化物的水化物反应的离子方程式
(5)标准状况下,将一支充满了L、K和O2的混合气体的烧瓶倒扣在盛满水的水槽里,水充满烧瓶,求烧瓶内溶液的浓度c的范围___________________mol/L(用分数表示,无需化简,假设生成的液体不扩散)
查看答案和解析>>
科目:高中化学 来源: 题型:
在阿司匹林的结构简式(如图)中①②③④⑤⑥分别标出了
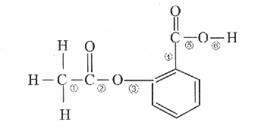 其分子不同的键。将阿司匹林与足量NaOH溶液共热时,发生反应时断键的位置是( )
其分子不同的键。将阿司匹林与足量NaOH溶液共热时,发生反应时断键的位置是( )
A.①④
B.②⑤
C.③④
D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
右图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是
①C ②H2O2 ③Na ④Fe ⑤HNO3
A.仅①③④ B.仅①②⑤
C.仅①②③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:
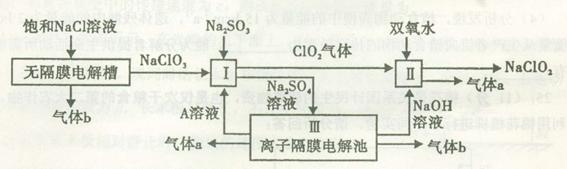
(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07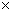 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中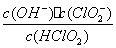 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液一定呈中性的是
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L的溶液
C.使酚酞试液呈无色的溶液 D.由强酸与强碱等物质的量反应得到的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O2=2CO2。则下列说法中正确的是( )
A.通CO的一极是电池的正极,
B.该电池工作过程中需不断补充CO和O2,CO2可循环利用
C.负极反应式:O2+2CO2+4e-==2CO32-
D.该电池工作过程中有蓝色火焰产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com