
【题目】用“吸收—电解”循环法脱除烟气中的SO2,可减少对大气的污染。室温下,电解液K再生的装置如图所示,其中电解液的pH随![]() 变化的关系见下表,下列对此判断正确的是
变化的关系见下表,下列对此判断正确的是
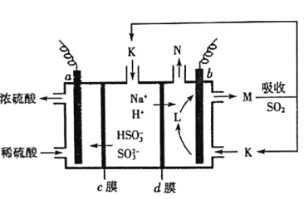
电解液 | n(SO32-):n(HSO3-) | pH |
K | 9:91 | 6.2 |
L | 1:1 | 7.2 |
M | 91:9 | 8.2 |
A.当电解液呈中性时溶液中:![]()
B.再生液M吸收SO2主反应的离子方程式为:![]()
C.HSO3-在b极发生的电极反应式为:![]()
D.若产生标准状况下2.24L气体N,则d膜上共通过0.2mol阳离子
【答案】D
【解析】
根据装置图,阴离子通过c膜向a极移动,可知a极为阳极,发生的反应为:HSO3--2e-+H2O=SO42-+3H+;b极为阴极,发生的反应为:2H++2e-=H2↑,气体N为H2。
A.n(SO32-):n(HSO3-)=9:91时,电解液pH=6.2,n(SO32-):n(HSO3-)=1:1时,电解液pH=7.2,由此推知当电解液呈中性时,c(HSO3-)>c(SO32-),A项错误;
B.M吸收SO2主要发生的反应为:SO32-+SO2+H2O=2HSO3-,B项错误;
C.b极为阴极,发生的反应为:2H++2e=H2↑,C项错误;
D.若产生标准状况下2.24L气体N(0.1molH2),阴极消耗0.2molH+,减少0.2mol正电荷,需要补充0.2mol正电荷以达到平衡,则d膜上会通过0.2mol阳离子,D项正确;
答案选D。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
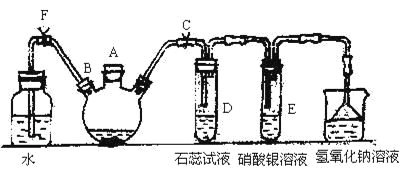
【题目】二氧化硫是常见的有刺激性气味的硫氧化物,是大气主要污染物之一。某学习兴趣小组设计如下所示装置制取SO2并探究其性质。

(1)仪器a的名称是________,装置B中观察到的现象是________。
(2)装置C中氯水褪色,证明SO2具有________(填“氧化性”“还原性”或“漂白性”)。
(3)装置D中出现淡黄色沉淀,发生反应的化学方程式为________。
(4)某同学认为在A、B间应增加F装置,该装置的作用是________。
(5)装置E能否证明SO2是酸性氧化物________(填“能”或“不能”),理由是________。
(6)硫的氧化物是形成酸雨的主要物质之一。某小组采集酸雨样品,每隔一段时间测定一次样品pH,得数据如下:
时间 | 开始 | 8h | 16h | 24h | 32h | 40h | 48h |
pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
酸雨样品pH变小的主要原因是________(用发生反应的化学方程式解释)。某同学在48h后偶然测得样品的pH又减小到3.9,导致样品pH再次减小的原因可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯可用如图所示的装置,填写下列空白:
(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,反应一段时间制的溴苯。溴苯是一种密度比水 (填”小”或”大”)的无色液体,在实验中因为 而显褐色。则三口烧瓶中发生反应的化学方程式为___ __和__ _。
(2)D、E试管内出现的现象为_____________________________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C,可以看到的现象是__________________。
(4)三口烧瓶中的溴苯经过下列步骤分离提纯:
①向三口烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为_____________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
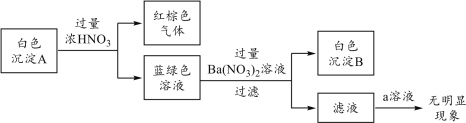
请回答:
①根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_Cu2++_SCN-=_CuSCN↓+_(SCN)2
⑤结合上述过程以及Fe(SCN)3![]() Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 分离酒精和水 | 分离胶体和溶液 | 除去碳酸钠固体中的碳酸氢钠 | 比较碳酸钠和碳酸氢钠的稳定性 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾(![]() )是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中
)是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中![]() 的纯度:
的纯度:
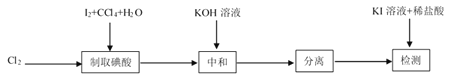
其中制取碘酸(![]() )的实验装置见图,有关物质的性质列于表中
)的实验装置见图,有关物质的性质列于表中
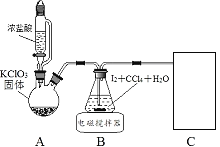
物质 | 性质 |
HIO3 | 白色固体,能溶于水,难溶于CCl4 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生氧化反应:ClO-+IO3-=IO4-+Cl- |
回答下列问题
(1)装置A中参加反应的盐酸所表现的化学性质为______________。
(2)装置B中反应的化学方程式为___________________ 。B中所加CCl4的作用是_________从而加快反应速率。
(3)分离出B中制得的![]() 水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低
水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低![]() 的产率。
的产率。
(4)为充分吸收尾气,保护环境,C处应选用最合适的实验装置是____________(填序号)。
(5)为促使![]() 晶体析出,应往中和所得的
晶体析出,应往中和所得的![]() 溶液中加入适量的___________。
溶液中加入适量的___________。
(6)取1.000g![]() 产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L
产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L![]() 溶液滴定。滴定至终点时蓝色消失(
溶液滴定。滴定至终点时蓝色消失(![]() ),测得每次平均消耗
),测得每次平均消耗![]() 溶液25.00mL。则产品中
溶液25.00mL。则产品中![]() 的质量分数为___(结果保留三位有效数字)。
的质量分数为___(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Garnet型固态电解质被认为是锂电池最佳性能固态电解质。LiLaZrTaO材料是目前能达到最高电导率的Garnet型电解质。某Garnet型可充电锂电池放电时工作原理如图所示,反应方程式为:LixC6+Li1-xLaZrTaO![]() LiLaZrTaO+6C,下列说法不正确的是
LiLaZrTaO+6C,下列说法不正确的是
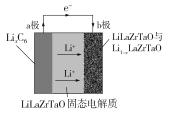
A.放电时,a极为负极,发生氧化反应
B.LiLaZrTaO固态电解质起到传导Li+的作用
C.充电时,b极反应为:LiLaZrTaO -xe-=xLi++Li1-xLaZrTaO
D.充电时,每转移xmol电子,a极增重7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①Na2CO3溶液 ②NaOH固体 ③CO2 ④石墨 ⑤熔融BaCl2五种物质,按要求回答下列问题:
(1)属于电解质的是____________(填代号,下同);属于非电解质的是____________;能导电的是______________。
(2)上述物质中有些物质在一定条件下可以反应,请按要求写出相应的化学方程式:
①是化合反应,也是氧化还原反应_________________________________。
②是化合反应,不是氧化还原反应_________________________________。
③是复分解反应,且有沉淀生成__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750°C左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。

试回答下列问题:
(1)甲装置中盛放的是____________,甲、乙中的吸收剂能否颠倒?____________________,请说明理由:_______________________________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么?____________________________。
(3)将4.6 g有机物A进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质中各元素的原子个数比是________________。
(4)经测定,有机物A的核磁共振氢谱示意图如图,则A的结构简式为__________________。
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com