
����Ŀ��Ϊ��֤��Ԫ�صķǽ����Ա���Ԫ�صķǽ�����ǿ��ij��ѧʵ��С�����������ʵ�飬��ش��������⣺ 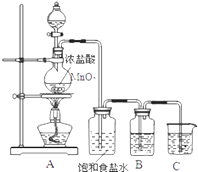
��1��װ��B��ʢ�ŵ��Լ�������ѡ���ʵ������Ϊ �� ��ѧ��Ӧ����ʽ�� ��
A��Na2S��Һ B��Na2SO3��Һ C��Na2SO4��Һ
��2��װ��C��ʢ���ռ�ϡ��Һ��Ŀ���� ��
��3����֤����Ԫ�ر���Ԫ�طǽ�����ǿ������Ϊ �� ������ţ�
����ԭ�ӱ���ԭ�Ӹ�����õ����γ����ӣ�
�ڴ�����������Ա�ϡ����ǿ��
��S2����Cl����ԭ��ǿ��
��HCl��H2S�ȶ���
��4����Bƿ��ʢ��KI��Һ��CCl4�Լ���ʵ��������ã�����ֵ�ʵ������ �� д����Ӧ�����ӷ���ʽ ��
���𰸡�
��1��A����������ɫ������Na2S+Cl2=2NaCl+S��
��2��������������ֹ��Ⱦ����
��3���٢ۢ�
��4���²�Ϊ��ɫ��2I��+Cl2=2Cl��+I2
���������⣺��1��Ҫ��C�з��������û�����ķ�Ӧ���ڸ����Լ���ֻ��ѡȡNa2S��Һ�����������û���Ӧ�����ӷ���ʽΪ��Cl2+S2���T2Cl��+S������Ӧ���е���ɫ�������������Դ��ǣ�A����������ɫ������Na2S+Cl2=2NaCl+S������2������Ϊ�ж����壬Ҫ����β��������������������������Һ��Ӧ������װ��C��ʢ���ռ���Һ��������������������ֹ��Ⱦ���������Դ��ǣ�������������ֹ��Ⱦ��������3����֤����Ԫ�ر���Ԫ�طǽ�����ǿ�����ݢ���ԭ�ӱ���ԭ�Ӹ�����õ����γ����ӣ��õ�������Խǿ�ǽ�����Խǿ������ȷ����ͨ����ۺ���������Կ��ԱȽϷǽ����ԣ����ܱȽ��������ԣ��ʴ����S2����Cl����ԭ��ǿ�����������ӵĻ�ԭ��Խ���ǽ�����Խǿ���жϣ�����ȷ���⻯��Խ�ȶ����ǽ�����Խǿ������ȷ�����Ԣ٢ۢܣ����Դ��ǣ��٢ۢܣ���4��������⻯�ط�Ӧ���ɵ��ʵ⣬��CCl4�Լ�����Һ��ֲ㣬�²�Ϊ�ⵥ�ʺ�CCl4 �� �����²����ɫ���䷴Ӧ�����ӷ���ʽΪ��2I��+Cl2=2Cl��+I2 �� ���Դ��ǣ��²�Ϊ��ɫ��2I��+Cl2=2Cl��+I2 ��
�����㾫����������Ĺؼ���������ǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ��ɵ����֪ʶ��������Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ�أ�


 Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�ij�ݻ�Ϊ2L���ܱ������ڣ�ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ������˵����ȷ���ǣ� �� 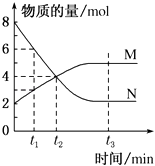
A.��Ӧ��ʼ��t2ʱ����Ӧ�ﵽƽ��״̬
B.��Ӧ��ʼ��t1��t1=1s����N�����ʵ���Ũ�ȱ仯��2mol/L
C.��Ӧ��ʼ��t2��t2=2s������M��ʾ��Ӧ����Ϊ0.5mol/��L��s��
D.��Ӧ�Ļ�ѧ����ʽΪ��N��g��2M��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���ڻ�ԭ��Ӧ����
A. Fe �� FeSO4 B. AgNO3�� Ag C. S ��SO2 D. CO32-- ��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ�������������ǣ� ��
A.���ڲ�������B.������ˮ�ұ�ˮ��
C.�����к���̼̼˫��D.����ʹ���Ը��������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�����������˵����ȷ���� �� ��
A. ��״���£�22.4 LHF�к���NA������
B. ��״���£�11.2 L NO��11.2 L O2��Ϻ�ԭ������С��2NA
C. 5.6g Fe��һ������ϡ���ᷴӦ��ת�Ƶ���������Ϊ0.26NA
D. ��1 L 2 mol/L��FeCl3��Һ���뵽��ˮ�У�����ʹ֮��ȫ��Ӧ�����������������彺����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C�Ľṹ��ʽ���£�
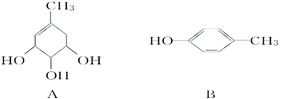
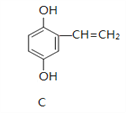
��1��A�����к��еĹ����ŵ�������_____________________��
��2������NaOH��Һ��Ӧ����_________������A������B������C������д����NaOH��Һ��Ӧ�Ļ�ѧ����ʽ_________________________________________������дһ����
��3��A��Ũ���������¼��ȿɵõ�B���䷴Ӧ������_________________��
��4��1 molC�ֱ���Ũ��ˮ��H2��Ӧʱ���������Br2 _____ mol������H2 ____ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Σ���ֿ������������ơ��ء�����(P4)������狀��軯��(KCN)��Σ��Ʒ����ش��������⣺
(1)NH4NO3Ϊ��ը���ij�¶��°���ʽ���зֽ⣺5NH4NO3=4N2��+2HNO3+9H2O�������ͱ���ԭ�ĵ�Ԫ������֮��Ϊ________��
(2)����ͭ��Һ�ǰ��������ж���һ�ֽⶾ����1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4����8molH3PO4���ɣ���CuSO4������P4�����ʵ���Ϊ______________mol��
(3)����CNһ���õ�һ�ַ�������������������ij����ˮ�к�KCN����Ũ��Ϊ650mg / L���������������������������·�Ӧ������N��Ϊ��3�ۣ���KCN��2KOH��Cl2 = KOCN��2KCl��H2O ����Ͷ�����Һ�ȣ��ɽ������ν�һ������Ϊ����N2��CO2����д���÷�Ӧ�Ļ�ѧ����ʽ��____��������������ˮ20 L��ʹKCN��ȫת��Ϊ�����ʣ�������Һ��_________ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨCuSO4��xH2O�����xֵ�������������ʾ����֪x������ֵΪ5.0���������Ŀ���ԭ����
�������� | ����+���� | ʧˮ������+���� |
11.70g | 20.82g | 16.50g |
A. �����к����ӷ����� B. δ�����ز���
C. ����ʱ�о��彦�� D. ����ǰ����δ��ĥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com