
| A. | 加水稀释,HCO3-?H++CO32-平衡右移,溶液中氢离子浓度减小 | |
| B. | 加水稀释后,碳酸氢根离子水解平衡向右移动,溶液中氢氧根离子浓度减小 | |
| C. | 加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| D. | 温度升高,c(HCO3-)增大 |
分析 A.加水稀释后,促进HCO3-水解,但氢氧根离子浓度减小,结合Kw分析;
B.加水稀释后,促进HCO3-水解,但氢氧根离子浓度减小;
C.加水稀释后,促进HCO3-水解,n(OH-)增大,结合Kw分析;
D.HCO3-水解为吸热反应,升高温度,促进水解.
解答 解:A.加水稀释后,促进HCO3-水解,但氢氧根离子浓度减小,由于Kw不变,所以氢离子浓度增大,故A错误;
B.加水稀释后,促进HCO3-水解,n(OH-)增大,由于溶液体积的增大程度大于氢氧根离子的物质的量增大程度,所以c(OH-)减小,故B错误;
C.25℃时,加水稀释后,促进HCO3-水解,n(OH-)增大,c(OH-)减小,由Kw不变,可知c(H+)增大,则n(H+)增大,则n(H+)与n(OH-)的乘积变大,故C正确;
D.HCO3-水解为吸热反应,升高温度,促进水解,则c(HCO3-)减小,故D错误;
故选C.
点评 本题考查盐的水解及其影响因素,涉及电离、水解及溶液中离子浓度关系的考查,选项C为解答的易错点,注意稀释促进水解时浓度与物质的量的变化不同,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | H3+的电子式为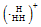 | |
| B. | H3+可进行反应,在液态氢中形成H4+、H6+、H8+ | |
| C. | H3+可在液态氢中形成H5+、H7+、H9+ | |
| D. | H3+广泛存在于固态、液态和气态氢中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阳离子一定是金属离子,阴离子一定只含非金属元素 | |
| B. | 金属阳离子一定只具有氧化性,没有还原性 | |
| C. | 阴、阳离子相互作用后不一定形成离子化合物 | |
| D. | 金属和非金属化合一定生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL 3mol/L NaCl溶液 | B. | 400mL 2.5mol/L MgCl2溶液 | ||
| C. | 300mL 1mol/L AlCl3溶液 | D. | 200mL1mol/L 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有7个主族,7个副族,共14个纵行 | |
| B. | 氮元素位于第二周期第三主族 | |
| C. | 金属性最强的元素是Li | |
| D. | 非金属性最强的元素是F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
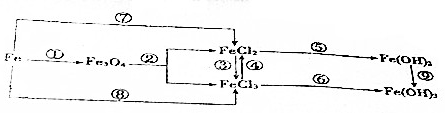
| A. | ③反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 钢铁腐蚀时,负极发生的反应是Fe-3e-═Fe3+ | |
| C. | 以Fe为电极,电解饱和NaCl溶液,阳极反应式为2Cl--2e-═Cl2↑ | |
| D. | FeCl2溶液中混有少量FeCl3,可以加入Fe、Cu等金属除去FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+2HCl=CaCl2+H2O | B. | CaO+H2O=Ca(OH)2 | ||
| C. | CaCO3=CaO+CO2↑ | D. | 2 H2O2=2H2O+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com