
核潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法中正确的是
A.该合金的熔点介于钠、铝之间
B.钠或铝形成的氧化物均为碱性氧化物
C.钠和铝分别与足量的盐酸反应,所得溶液均呈中性
D.若合金中n(Na)>n(Al) ,将其投入到足量的水中,可得无色透明溶液
,将其投入到足量的水中,可得无色透明溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,错误的是
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
④密度为1.1 g·cm-3与密度为1.2 g·cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g·cm-3与1.2 g·cm-3之间,Na-K合金的熔点应介于Na和K熔点之间
A.①② B.①④ C.①②③④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
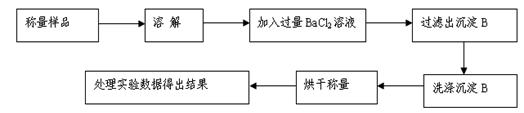 方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]
(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为 。
(2)洗涤沉淀B的操作是 。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
方案Ⅱ.乙组同学的主要实验流程图如下:
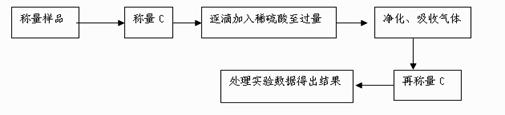

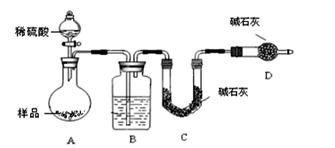 按如下左图所示装置进行实验:
按如下左图所示装置进行实验:
(4)该实验中装置B盛放的物质是_____________________,分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中干燥管C在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________________。
(6)有同学认为为了减少实验误差,在反应前后都要通入N2(如上右图),反应后通入
N2的目的是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合金与纯金属制成的金属材料相比,优点是
①合金的硬度一般比它的各成分金属的大 ②一般地,合金的熔点比它的各成分金属的更低 ③改变原料的配比、改变生成合金的条件,得到有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.②③④ B.①②③⑤
C.①②④ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在冶金工业上,均不能用化学还原剂制得的一组金属是
A.Na、Mg、Al B.Na、K、Zn、Fe
C.Zn、Fe、Cu、Ag D.Mg、Al、Zn、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了如下实验测量m g铜银合金样品中铜的质量分数:

下列说法中不正确的是
A.合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性
B.铜银都能与稀硝酸反应,收集到的V L气体全为NO
C.操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ应是烘干
D.根据反应收集到的气体体积可以计算铜和银的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
大多数物质的俗名是根据其特殊的物理性质或用途得来的。下列物质的俗名与化学式或用途不相符的一组是
| 俗名 | 主要成分(化学式) | 用途 | |
| A | 石英 | SiO2 | 集成电路板 |
| B | 纯碱 | Na2CO3 | 制备玻璃 |
| C | 水玻璃 | Na2SiO3 | 制备硅胶 |
| D | 铁红 | Fe2O3 | 用做油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,我国的材料研究迅猛发展,出现了许多具有特殊功能的新型材料。
(1)硅是将太阳能转换为电能的常用材料,从硅的氧化物制取粗硅的化学方程式为________________________________________________________________________。
(2)化合物G是开发新一代汽车发动机的新材料。G的相对分子质量为140,含有硅元素,其质量分数为60%,另含有元素Y。E(含两种元素)与NH3反应制得G和HCl。G和E化学式分别为________________________________________________________________________。
常压条件下向G中添加氧化铝,经高温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,化学通式可表示为Si6-xOxY8-x。在接近1 700 ℃时x的极限值约为4.0,则化合物中Y元素的化合价为________。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温被H2还原而得,已知铁酸盐(MFe2O4)高温还原时,发生反应的MFe2O4与H2的物质的量之比为2∶1,则还原产物MFe2Ox中x=____________。MFe2Ox中,+2价铁与+3价铁的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硫酸钠中+4价的硫既有氧化性又有还原性。现有试剂:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液、氨水。
(1)要证明亚硫酸钠溶液具有还原性,应选用的试剂有 ;观察到的现象是 ;
反应的离子方程式是
(2)要证明亚硫酸钠溶液具有氧化性,应选用的试剂有 ;观察到的现象是 ;
反应的离子方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com