
【题目】回答下列问题:
(1)0.005mol/L的H2SO4溶液的pH为_______。
(2)常温时,0.1mol/L的NaOH和0.06mol/L的H2SO4溶液等体积混合,求混合溶液的pH为_______。
(3)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=________,该温度________(填“高于”或“低于”)25 ℃。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。若所得混合溶液呈中性,则a∶b=________。
【答案】2 2 10-13 高于 1:100
【解析】
(1)0.005mol/L的H2SO4溶液中,c(H+) =0.01mol/L,由此可求出pH。
(2)常温时,0.1mol/L的NaOH和0.06mol/L的H2SO4溶液等体积混合,H2SO4溶液过量,则先求c(H+) ,再求混合溶液的pH。
(3) 0.01 mol·L-1的NaOH溶液的c(OH-)=0.01mol/L,pH为11,c(H+)=10-11mol/L,则该温度下水的离子积常数Kw=c(H+)c(OH-),由此确定该温度与25 ℃的关系。
(4)常温下,pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L, pH=3的H2SO4溶液中c(H+)=10-3mol/L,若所得混合溶液呈中性,利用n(H+)=n(OH-),求出a∶b。
(1)0.005mol/L的H2SO4溶液中,c(H+) =0.01mol/L, pH=-lg c(H+)=2。答案为:2;
(2)常温时,0.1mol/L的NaOH和0.06mol/L的H2SO4溶液等体积混合(设体积都为1L),H2SO4溶液过量,则先求c(H+) =![]() =0.01mol/L,pH=2。答案为:2;
=0.01mol/L,pH=2。答案为:2;
(3) 0.01 mol·L-1的NaOH溶液的c(OH-)=0.01mol/L,pH为11,c(H+)=10-11mol/L,则该温度下水的离子积常数Kw=c(H+)c(OH-)=10-11×0.01=10-13>10-14,该温度高于25 ℃。答案为:10-13;高于;
(4)常温下,pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,pH=3的H2SO4溶液中c(H+)=10-3mol/L,若所得混合溶液呈中性,利用n(H+)=n(OH-),得出0.1mol/L×aL=10-3mol/L×bL,求出a∶b=1:100。答案为:1:100。


科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数;______________
(2)混合后溶液的物质的量浓度;(保留到小数点后一位,下同)___________
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三份浓度均为0.1 mol/L,体积均为1 L 的CH3COONa 溶液中分别加入NH4Cl 固体、CH3COONH4固体、HCl 气体后所得溶液pH 变化曲线如图(溶液体积变化忽略不计)下列说法不正确的是
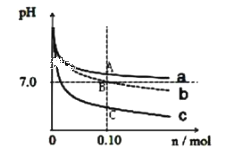
A.曲线 a、b、c 分别代表加入 CH3COONH4、NH4Cl、HCl
B.由图可知 Ka(CH3COOH)=Kb(NH3﹒H2O)=1×10-7
C.A点处 c(CH3COO-)>c(Na+)> c(NH4+)> c(OH-)> c(H+)
D.C点处 c(CH3COO-)+c(Cl-)+c(OH-)>0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的两种弱酸HA和HB分别加水稀释,pH随溶液体积变化的曲线如图所示。下列判断正确的是( )
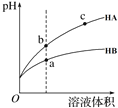
A.酸性:HB> HA
B.结合H+的能力:B->A-
C.导电能力:c > b
D.与氢氧化钠完全反应时,消耗氢氧化钠体积Va<Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业的核心反应是N2(g)+3H2(g) ![]() 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
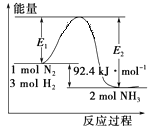
(1)该反应的ΔH=_______kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1 _____(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量_________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol 4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2 =-2954kJ/mol,则该温度下白磷转化为红磷的热化学方程式:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质制取的化学方程式中,不属于氧化还原反应的是( )
A.实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑
B.实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑
C.实验室制取氯气:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.工业上制取二氧化氯:2NaClO3+4HCl(浓)=2NaCl+2H2O+2ClO2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”主要反应原理是:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的Na2CO3,主要实验包括:制取NH3和CO2→生成NaHCO3→分离NaHCO3→制取Na2CO3 四个步骤。下列实验选用的主要仪器或主要步骤不正确的是
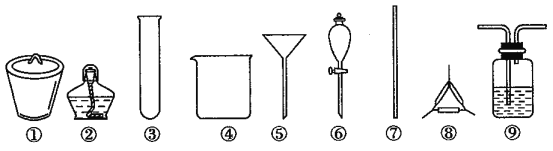
A. 制取氨气,可选用②③
B. 分离 NaHCO3,可选用④⑤⑦
C. 制取 Na2CO3,可选用①②⑦⑧
D. 制取 NaHCO3时,应先在⑨中通入CO2后再加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质结构的说法不正确的是
A.在NH3和PH3分子中键长:N-H>P-H
B.晶格能:NaF>NaCl>NaBr
C.CS2的填充模型:![]()
D.CH4和NH4+都是正四面体结构,键角均为109°28′
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com