
【题目】化学与生活息息相关,下列叙述不正确的是( )
A.用活性炭可去除冰箱中的异味
B.单质硅是将太阳能转变为电能的常用材料
C.医用酒精的浓度通常为95%
D.硅胶可用作食品干燥剂
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2可用作有机合成的催化剂,某校同学设计实验用干燥的HBr与Fe反应制备少量FeBr2,实验装置如下(部分夹持装置已省略):
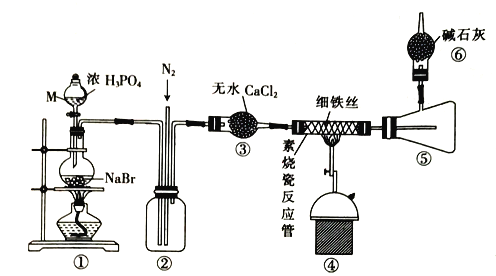
已知:高温时FeBr3会分解为FeBr2,FeBr2易吸水潮解,800℃以上可升华。
回答下列问题:
(1)仪器M的名称是____________;装置①中生成HBr的化学方程式为___________。
(2)反应开始前通入N2的目的是____________,反应过程中通入N2的目的是____________。
(3)进入装置④的气体中混有少量Br2对产品纯度_______(填“有”或“没有”)影响,理由是___________。
(4)装置⑥的作用是___________,逸出的气体主要是___________(填化学式)。
(5)设计实验方案探究得到的FeBr2中Fe2+和Brˉ的还原性强弱:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质。下列说法错误的是( )
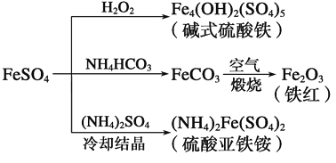
A. 碱式硫酸铁水解能产生 Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3 分解,生产FeCO3需在较低温度下进行
C. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4 的大
D. 可用KSCN溶液检验(NH4)2Fe(SO4)2 是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A. 肯定有SO2和NO
B. 肯定没有Cl2、O2和NO2
C. 可能有Cl2和O2
D. 肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C4H7ClO2的同分异构体甚多, 其中能与 NaHCO3发生反应产生CO2的同分异构体共有(不考虑立体异构)
A.3种B.4种C.5种D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。下列描述正确的是( )

A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
C. 每消耗1molX同时生成2mol Z,说明反应已达平衡
D. 反应开始到10s时,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:

下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com