
分析 (1)根据相对密度与摩尔质量成正比计算出该有机物的摩尔质量,然后分别根据该元素的含量计算出其分子中含有的C、H、O原子数,从而确定其分子式;
(2)此有机物既可与金属钠反应,又可与氢氧化钠反应,说明其分子中含有羧基,然后根据A的分子式确定其结构简式.
解答 解:(1)有机物与H2的相对密度为30,则MA=30×MH2=30×2g/mol=60 g/mol,A的分子量为60,
含O的质量分数为:1-40%-6.6%=53.4%,
A分子中含有C、H、O原子数分别为:N(C)=$\frac{60×40%}{12}$=2、N(H)=$\frac{60×6.6%}{1}$=4、n(O)=$\frac{60×53.4%}{16}$=2,
则有机物A的分子式为C2H4O2,
答:该有机物的分子式为C2H4O2;
(2)该有机物既可与金属钠反应,又可与氢氧化钠反应,则其分子中含有-COOH,则该有机物的结构简式为CH3COOH,
答:该有机物的结构简式为CH3COOH.
点评 本题考查了有机物的分子式、结构简式,题目难度中等,明确摩尔质量与相对密度的关系为解答根据,注意掌握常见有机物结构与性质,试题培养了学生灵活应用基础知识的能力.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| B. | 将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 | |
| C. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
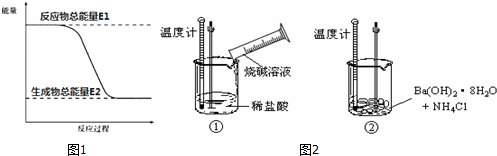
 学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:
学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
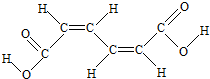
| A. | 已知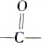 为平面结构,则该有机物分子中最多有16个原子在同一平面内 为平面结构,则该有机物分子中最多有16个原子在同一平面内 | |
| B. | 1mol该有机物可以和2mol NaOH反应,但不能用Na2CO3溶液区分该有机物和CH3COOCH2CH3 | |
| C. | 该有机物能发生加成反应不能发生取代反应 | |
| D. | 该有机物和乙酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
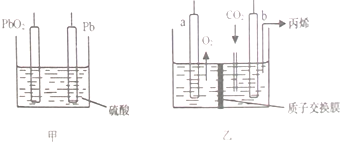
| A. | 为实现工作原理,PbO2电极应与b电极相连 | |
| B. | b电极反应式为:3CO2+18e-+18H+=6H2O+CH3CH=CH2 | |
| C. | 在铅蓄电池供电过程中,Pb电极质量不断减小 | |
| D. | 乙装置中H+由b电极向a电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:
已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com