
分析 电解质:在水溶液中或融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
物质导电的条件:含有自由移动的电子或者自由移动的离子.
解答 解:①蔗糖在水溶液中和熔融状态下不能导电的化合物,属于非电解质,不含自由移动的电子或者自由移动的离子,不导电;
②熔融NaCl在水溶液中或融状态下能导电的化合物,属于电解质,含有自由移动的离子,导电;
③盐酸为混合物,既不是电解质也不是非电解质,含有自由移动离子,能够导电;
④铜丝为单质,既不是电解质也不是非电解质,含有自由移动电子,能够导电;
⑤NaOH固体在水溶液中或融状态下能导电的化合物,属于电解质,不含自由移动的电子或者自由移动的离子,不导电;
⑥液氧是单质既不是电解质也不是非电解质,不含自由移动的电子或者自由移动的离子,不导电;
⑦CuSO4固体在水溶液中或融状态下能导电的化合物,属于电解质,不含自由移动的电子或者自由移动的离子,不导电;
⑧酒在水溶液中和熔融状态下不能导电的化合物,属于非电解质,不含自由移动的电子或者自由移动的离子,不导电;
⑨CO2 本身不能电离产生自由移动的离子,是非电解质,不含自由移动的电子或者自由移动的离子,不导电;
⑩Na2SO4溶液为混合物,既不是电解质也不是非电解质,含有自由移动离子,能够导电;
所以:属于电解质的是②⑤⑦;属于非电解质的是①⑧⑨;能导电的是②③④⑩;
故答案为:②⑤⑦;①⑧⑨;②③④⑩.
点评 本题考查了电解质、非电解质判断,明确电解质、非电解质概念是解题关键,注意单质与混合物既不是电解质也不是非电解质,题目难度不大.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
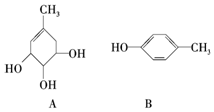 A、B的结构简式如图:
A、B的结构简式如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的邻位二元取代物只有一种 | B. | 苯的间位二元取代物只有一种 | ||
| C. | 苯的对位二元取代物只有一种 | D. | 苯的邻位二元取代物有二种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
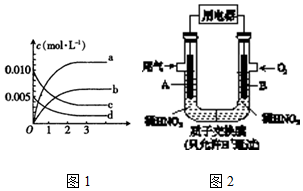
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 活性炭/mol | NO/mol | A/mol | B/mol | ρ/Mpa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 | ρ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com