
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL 5mol/L的盐酸 | B. | 500mL 1mol/L的氯化钠溶液 | ||
| C. | 100mL 3mol/L的硫酸 | D. | 250mL 2mol/L的氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
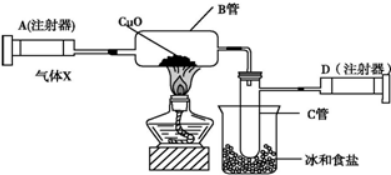
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,A是直流电源的正极,C、D均为石墨电极,E、F均为铜电极.分别写出C、D、E、F四个电极的电极反应式.
如图所示,A是直流电源的正极,C、D均为石墨电极,E、F均为铜电极.分别写出C、D、E、F四个电极的电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1mol•L-1的下列溶液中:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4mol•L-1CH3COOH溶液和0.2mol•L-1NaOH溶液等体积混合后溶液显酸性,溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1 Na2CO3溶液与0.2mol•L-1NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)═c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1mol•L-1的氨水与0.05mol•L-1H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)═2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com