
| A. | MgO+H2SO4═MgSO4+H2O | B. | Na2O+H2O═2NaOH | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | SO3+H2O═H2SO4 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3kJ.mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ.mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则CO2(g)═2CO(g)+O2(g)的反应热△H=+2×283.0 kJ/mol | |
| C. | NaOH和HCl反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{550℃,30Mpa}^{催化剂}$2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
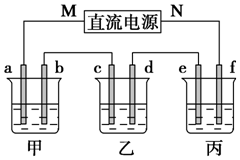 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
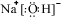 ,并指出其中存在的化学键.离子键和共价键
,并指出其中存在的化学键.离子键和共价键查看答案和解析>>
科目:高中化学 来源: 题型:实验题
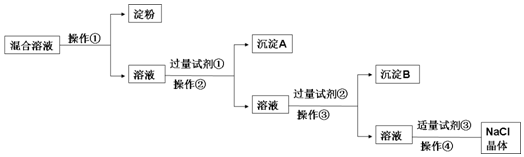
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:填空题
为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。


(1)化学反应速率最快的时间段是 ,影响此时间段反应速率的主要因素是 ;
A.O~t1 B.t1~t2 C.t2~t3 D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸中加入下列物质,你认为可行的有 ;
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl
(3)若盐酸的体积是20 mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率v(HCl)= mol·(L·min)-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com