
分析 氯气可以氧化亚铁离子、碘离子,反应方程式为:2FeI2+3Cl2=2FeCl3+2I2,根据方程式计算参加反应氯气物质的量,再根据Cl元素化合价变化计算转移电子.
解答 解:氯气可以氧化亚铁离子、碘离子,反应方程式为:2FeI2+3Cl2=2FeCl3+2I2,1molFeI2反应需要Cl2的物质的量为1mol×$\frac{3}{2}$=1.5mol,反应中Cl元素化合价由0价降低为-1价,故转移电子为1.5mol×2=3mol,即转移电子数为3×6.02×1023个,
故答案为:3×6.02×1023;2FeI2+3Cl2=2FeCl3+2I2.
点评 本题考查氧化还原反应方程式书写及电子转移计算,比较基础,明确发生的反应是关键.


科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
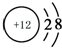 .
.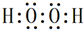 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
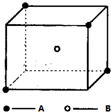 某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,A位于立方体的顶点,B位于立方体中心.试分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
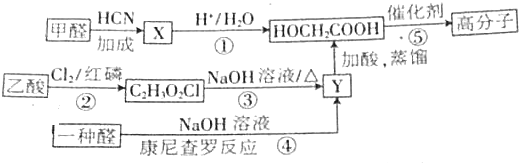
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-和NO3-可能来自同一工厂 | B. | Cl-和NO3-一定不在同一工厂 | ||
| C. | Ag+和Na+可能来自同一工厂 | D. | Na+和NO3-来自同一工厂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉与稀硫酸不反应,但加入一定量硝酸钠后铜粉会发生溶解 | |
| B. | 金属Na久置于空气中最终产物是生成Na2O2 | |
| C. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉有红棕色固体生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com