
 KClO3和KHSO3溶液混合发生氧化还原反应,结果氯元素被还原成最低价,硫元素被氧化成最高价,又知该反应速率随溶液中c(H+)增加而加快,反应过程中速率变化如图.
KClO3和KHSO3溶液混合发生氧化还原反应,结果氯元素被还原成最低价,硫元素被氧化成最高价,又知该反应速率随溶液中c(H+)增加而加快,反应过程中速率变化如图.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、维生素C高温时容易被破坏,所以不宜热锅爆炒蔬菜 |
| B、构成人体蛋白质的20多种氨基酸都能通过人体自身合成 |
| C、某些铁盐溶于水生成的Fe(OH)3胶体,可除去水中的悬浮颗粒等杂质 |
| D、可用燃烧的方法鉴别真丝围巾和合成纤维围巾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:
在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | H2CO3 | CH3COOH | NH3?H2O |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 |
K=1.75×10-5 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
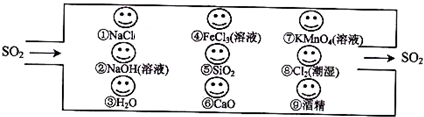
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第一电离能:①>② |
| B、原子半径:④>③ |
| C、电负性:②>③ |
| D、氢化物稳定性:①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com