
【题目】垃圾资源化的方法是 ( )
A. 填埋 B. 焚烧 C. 堆肥法 D. 分类回收法
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在—定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
(2)火箭残骸中存在红棕色气体,原因为:N2O4![]() 2NO2(g) △H
2NO2(g) △H
①当温度升高时,气体颜色变深,则反应为_______________( “吸热”或“放热”)反应。
②T℃,将1molN2O4充入恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态是____________
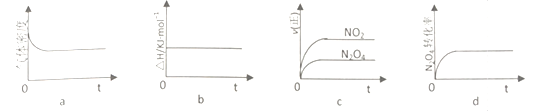
③T℃,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___________(填“增大”“ 不变”或“减小”)。
(3)已知 4HCl(g)+O2(g) ![]() 2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
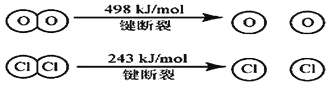
①写出该反应的热化学方程式___________________ 。
②断开1 mol H-O键与断开1 molH-C1键所需能量相差约为_________kJ,H2O中H-O键比HCl中H-Cl键___________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知20种氨基酸的平均相对分子质量是128,现有一蛋白质由两条肽链组成,共有肽键98个,则此蛋白质的相对分子质量是( )
A. 12800 B. 12544
C. 11036 D. 12288
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)及其化合物在工农业生产中有许多用途。以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示:

回答下列问题:
(1)“焙烧”时的硫酸浓度最好为_____(填标号)。
A.浓硫酸 B. 20%硫酸 C.50%硫酸 D. 80%硫酸
(2)“焙烧”过程中Cu2Se参与反应时,该反应的氧化产物是_______。
(3)“水吸收”所发生反应的化学方程式为____________。
(4)“过滤”所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:

蒸馏操作中控制的最佳温度是_____(填标号)。
A.455℃ B.462℃ C.475℃ D.515℃
(5)“水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是____________________,“浸渣”中含有的金属单质是___________。
(6)若“浸出液”中,c(Ag+)=3.0×10-2 mol/L,则溶液中c(SO42-)最大为___________________(已知:Ksp(Ag2SO4)=1.4×10-5,计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II.2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为_______反应(填“吸热”或“放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是______________(填“a”或“b”)。
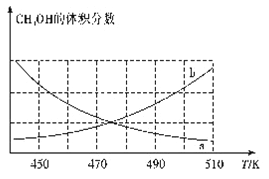
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4 min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。

(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,

(1)请写出NO2和CO反应的热化学方程式:
________________________________________________________;
又知:N2(g)+2NO2(g)===4NO(g) ΔH=+292.3 kJ·mol-1,则反应2NO(g)+2CO(g) =N2(g)+2CO2(g)的ΔH为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是学习和研究化学物质的一种常用科学方法.下列“链状连环”图案中,相连的两种物质均可归属为一类,相交部分A、B、C、D为其分类依据代号.请回答: ![]()
(1)请将A、B、C、D填入相应的横线内.
①两种物质都是氧化物
②两种物质都是盐
③两种物质都不是电解质
(2)用洁净的烧杯取25mL蒸馏水,加热至沸腾,逐滴加入上图中一种物质的饱和溶液5~6滴,继续加热,制得红褐色的胶体.
①以上反应的化学方程式为 .
②简述胶体制取成功的判断依据是 .
③向该胶体中逐滴加入稀硫酸,观察到:
A.先出现红褐色沉淀,说明胶体发生 .
B.随后红褐色沉淀溶解,反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是

A. 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B. 步骤②中反应利用的原理是:相同条件下NaHCO3的溶解度比NaCl小
C. 步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
D. 步骤④、⑤、⑥溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,能说明化学平衡一定向逆反应方向移动的是
A. N2O4(g)![]() 2NO2(g),改变某一条件后,气体颜色变浅
2NO2(g),改变某一条件后,气体颜色变浅
B. N2(g)+3H2(g)![]() 2NH3(g),改变某一条件后,NH3的体积分数减少
2NH3(g),改变某一条件后,NH3的体积分数减少
C. H2(g)+I2(g)![]() 2HI(g),单位时间内消耗H2和HI的物质的量之比等于1∶2
2HI(g),单位时间内消耗H2和HI的物质的量之比等于1∶2
D. 2SO2(g)+O2(g)![]() 2SO3(g),恒温恒压条件下,充入He
2SO3(g),恒温恒压条件下,充入He
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com