
【题目】下列有关同分异构体的叙述正确的是( )
A.分子组成是C5H10O2属于羧酸的同分异构体有5种
B.菲的结构简式为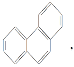 其一硝基取代物有10种
其一硝基取代物有10种
C.C3H8的二氯取代物最多有3种
D.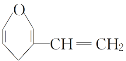 和
和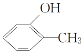 互为同分异构体
互为同分异构体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】高铁钢轨全部为无缝钢轨,钢轨焊接可以采用铝热法,其原理如图所示。下列叙述错误的是( )

A.铝热法炼铁的原理是
B.该实验需要关注的安全事项之一是纸漏斗与盛沙子的蒸发皿的距离不要太远,否则熔融的铁水易溅出伤人
C.点燃镁条,镁条剧烈燃烧,放出大量的热,使氧化铁粉末和铝粉在较高的温度下发生剧烈的反应
D.![]() 和
和![]() 的质量比要控制在
的质量比要控制在![]() ,且要混合均匀,以保证
,且要混合均匀,以保证![]() 和
和![]() 都能完全反应
都能完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:K3[Fe(CN)6]溶液是检验Fe2+的试剂,若溶液中存在Fe2+,将产生蓝色沉淀。将0.1mol/L的KI溶液和0.05mol/L Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“”2Fe3++2I-![]() 2Fe2++I2的是
2Fe2++I2的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①和③B.②和④C.③和④D.①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请应用化学反应原理的相关知识解决下列问题:
![]() 已知NaCl的溶解热为
已知NaCl的溶解热为![]() 吸热
吸热![]()
![]()
![]()
![]()
![]()
写出钠在氯气中燃烧的热化学方程式:__________。
![]() 一定条件下,在
一定条件下,在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,如图所示为反应体系中
,如图所示为反应体系中![]() 的平衡转化率与温度的关系曲线。已知在温度为
的平衡转化率与温度的关系曲线。已知在温度为![]() 的条件下,该反应
的条件下,该反应![]() 达到平衡状态;
达到平衡状态;
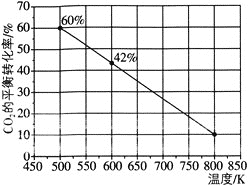
![]() 该反应是________
该反应是________![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
![]() 在
在![]() 时段反应速率
时段反应速率![]() 为_________。
为_________。
![]() 若改充入
若改充入![]() 和
和![]() ,图中的曲线会_________
,图中的曲线会_________![]() 填“
填“![]() 。
。
![]() 根据下表数据回答问题:
根据下表数据回答问题:
表1 ![]() 时浓度为
时浓度为![]() 两种溶液的pH
两种溶液的pH
溶质 | NaClO |
|
pH |
|
|
表2 ![]() 时两种酸的电离平衡常数
时两种酸的电离平衡常数
|
| |
|
|
|
|
|
|
![]() 根据表1能不能判断出
根据表1能不能判断出![]() 与HClO酸性强弱?_____________
与HClO酸性强弱?_____________![]() 填“能”或“不能”
填“能”或“不能”![]() 。
。
![]() 溶液中离子浓度由大到小的顺序为__________。
溶液中离子浓度由大到小的顺序为__________。
![]() 溶液和
溶液和![]() 溶液反应的离子方程式为________。
溶液反应的离子方程式为________。
![]() 已知:
已知:![]() 时,
时,![]() 、
、![]() ;AgCl为白色沉淀,
;AgCl为白色沉淀,![]() 为砖红色沉淀。
为砖红色沉淀。![]() 时,向
时,向![]() 和
和![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 溶液至过量且不断搅拌,实验现象为__________。
溶液至过量且不断搅拌,实验现象为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器或用品:①铁架台(含铁圈、各式铁夹)②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒(普通) ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩漏斗;
现有下列药品:a.NaOH固体 b.标准NaOH溶液 c.未知浓度盐酸 d.蒸馏水e.碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是______________。
(2)做中和反应反应热的测定实验时,还缺乏的玻璃仪器有____________、___________。
(3)准确量取25.00ml碳酸钠溶液,可选用的仪器是__________。
A.25ml量筒 B.25ml酸式滴定管
C.25ml碱式滴定管 D.有刻度的50ml烧杯
(4)进行中和滴定时,不可预先用待装液润洗的仪器是下列的__________(填编号)。
A、酸式滴定管 B、碱式滴定管 C、锥形瓶
(5)用标准强碱溶液滴定盐酸时,滴定前,滴定管尖端有气泡,滴定后气泡消失,会使得测定的盐酸浓度结果_____________。(填“偏高”、“偏低”或“不影响”,下同)
(6)用标准强碱溶液去滴定未知浓度盐酸,用滴定管取10.00ml盐酸溶液入锥形瓶时,前仰视、后俯视读数,会使得测定的盐酸浓度结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
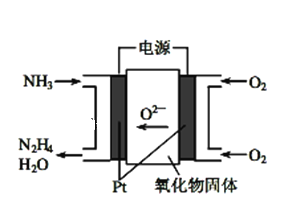
【题目】(1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为______________________,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应_________________________;
(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) △H=-akJ/mol,己知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式: _______________________________。
CO2(g)+H2(g) △H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇及水蒸气,并放出热量,写出该反应的热化学反应方程式: _______________________________。
(3)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
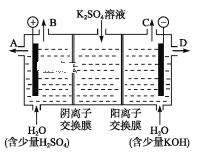
①该电解槽的阳极反应为_______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)_______导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
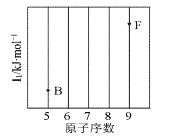
【题目】(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置_______。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
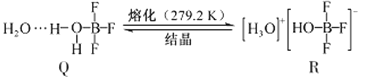
①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚(![]() )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com