
下列物质中,属于强电解质的是 (填序号,下同);属于弱电解质的是 ;属于非电解质的是 .
①氨气②氨水③盐酸④醋酸(CH3COOH)⑤硫酸钡⑥氯化银⑦氯化钠溶液⑧二氧化碳⑨醋酸铵⑩氢气.
考点: 强电解质和弱电解质的概念;电解质与非电解质.
专题: 电离平衡与溶液的pH专题.
分析: 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质;能全部电离的电解质是强电解质,只有部分电离的电解质是弱电解质.
解答: 解:强、弱电解质的区别在于其在水溶液中能否完全电离,电解质和非电解质都指的是化合物.氨气(NH3)、二氧化碳(CO2)本身不电离,又是化合物,所以是非电解质;氢气是单质,既不是电解质也不是非电解质;氯化钠溶液、氨水、盐酸都是混合物,即不是电解质也不是非电解质;“酸、碱、盐都是电解质”,所以醋酸(CH3COOH)、硫酸钡、氯化银、醋酸铵都是电解质,硫酸钡(BaSO4)、氯化银(AgCl)由于溶解度小,所以离子浓度小,虽然溶液导电性弱,但溶解的部分完全电离,所以BaSO4、AgCl不仅是电解质,而且是强电解质;CH3COOH、NH3•H2O在水溶液中只能部分电离,属于弱电解质,但两者反应的产物醋酸铵(CH3COONH4)在水溶液中完全电离,是强电解质.
故答案为:⑤⑥⑨;④;①⑧.
点评: 本题考查了电解质、非电解质、强电解质、弱电解质的判断,难度不大,注意电解质的强弱与电离程度有关与溶液的导电能力无关.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在溶液中能大量共存的离子组是( )
A. Na+、OH﹣、HCO3﹣ B. Ba2+、OH﹣、Cl﹣
C. H+、K+、CO32﹣ D. NH4+、NO3﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中()
A. 水的电离程度始终增大
B. 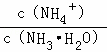 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO﹣)之和始终保持不变
D. 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为()
A. 大于2c mol/L B. 等于2c mol/L
C. 小于2c mol/L D. 在c mol/L∽2c mol/L之间
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是()
A. 该溶液中,K+、Fe2+、C6H5OH、Br﹣可以大量共存
B. 和KI溶液反应的离子方程式:Fe3++2I﹣═Fe2++I2
C. 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42﹣+Ba2++3OH﹣═Fe(OH)3↓+BaSO4↓
D. 1L O.1mol•L﹣1该溶液和足量的Zn充分反应,生成11.2g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是 、
(2)下列有关配制过程中说法错误的是 (填序号).
a.用电子天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90nL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br﹣被C12氧化成Br2溶解在溶液中; 假设2:Fe2+被C12氧化成Fe3+.
(1)请你完成表格,验证假设:
实验步骤、预期现象 结论
①溶液中加入适量四氯化碳 假设1正确
②向溶液中加入 假设2正确
若假设1正确,从实验①中分离出Br2的实验操作名称是 ;
(2)实验证明:还原性Fe2+>Br﹣,请用一个离子方程式来证明: ;
(3)若在50mL上述FeBr2溶液中通入5×10﹣3molCl2,反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 金属钠投入水中:Na+2H2O═Na++2OH﹣+H2↑
B. AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓
C. 铁和稀硝酸反应:Fe+2H+═H2↑+Fe2+
D. 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑+Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸和强碱在稀溶液里反应的热化学方程式可表示为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1已知:CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=﹣Q1 kJ•mol﹣1 HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=﹣Q2 kJ•mol﹣1上述均是在溶液中进行的反应,Q1、Q2的关系正确的是()
A. Q1=Q2=57.3 B. Q1>Q2>57.3 C. Q1<Q2=57.3 D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com