
| A. | ④ | B. | ④⑤ | C. | ①④⑤ | D. | ②④⑤ |
分析 ①一种物质组成的为纯净物,不同物质组成的为混合物;
②和碱反应生成盐和水的氧化物为酸性氧化物;
③和酸反应生成盐和水的氧化物为碱性氧化物;
④水溶液中或熔融状态下导电的化合物为电解质;
⑤水溶液中和熔融状态下都不导电的化合物为非电解质;
解答 解:①一种物质组成的为纯净物,不同物质组成的为混合物,碱石灰、水玻璃、氨水均为混合物,CuSO4•5H2O为纯净物,故①错误;
②和碱反应生成盐和水的氧化物为酸性氧化物,CO2、SO2、SO3均为酸性氧化物,NO、NO2、不符合酸性氧化物的概念,故②错误;
③和酸反应生成盐和水的氧化物为碱性氧化物,Na2O、Fe3O4、CaO均为碱性氧化物,Na2O2、和酸反应生成盐和水同时生成氧气,故③错误
④水溶液中或熔融状态下导电的化合物为电解质,CaO、CH3COOH、NH3•H2O、CaCO3均为电解质,故④正确;
⑤水溶液中和熔融状态下都不导电的化合物为非电解质,SO2属于酸性氧化物,Cl2不是电解质,乙醇、蔗糖均为非电解质,故⑤错误;
故选A.
点评 本题考查混合物、电解质、非电解质、酸性氧化物、碱性氧化物等概念,难度不大,注意这几个概念的区别


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ | |
| B. | 甲基橙呈黄色的溶液中;I-、Cl-、NO3-、Na+ | |
| C. | 石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| D. | 含大量Al3+的溶液中:K+、Na+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 15.5g | C. | 11.7g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
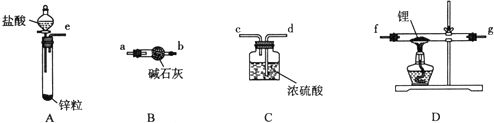
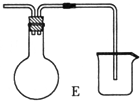
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:
茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| B. | H2A溶液在不同pH环境中各微粒的分布不同,电离平衡常数也不同 | |
| C. | 溶液的pH=4.5时,存在如下关系:C(Na+)>C(HA-)>C(A2-)>C(H+)>C(OH-) | |
| D. | 已知HClO的电离平衡常数为10-7.5将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+ClO-═HClO+HA- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com