
【题目】下列说法正确的是
A. 相同条件下,等体积的H2O和CO2含有相同的原子数
B. 等物质的量的Na2O2和Na2O所含阴离子数之比为2:1
C. 质量相等的O3与O2所含电子数相等
D. 相同体积、相同物质的量浓度的酸中氢离子的物质的量相等
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】飞船实行了载人航天,飞船应用了许多尖端的合成材料。下列物质中,不属于合成材料的是 ( )
A. 人造丝 B. 有机玻璃 C. 硅橡胶 D. 黏合剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作 (填“一定”/“一定不”/“不一定”)会导致实验结果有误差。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 。
(2)、用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考右图,从表中选出正确序号
序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |
|
A | 碱 | 酸 | 石芯 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 酚酞 | (乙) |
(3)、用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液的pH相比较(相同温度下)( )
A.前者大 B.相等 C.后者大 D.不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内的反应,其实质属于同一类型的是 ( )
A. 制备酚醛树脂、制取聚苯乙烯
B. 酯化反应,酯的水解
C. 制取聚丙烯、聚四氟乙烯、丁苯橡胶(单体为丁二烯和苯乙烯)
D. 乙烯水解、苯硝化反应、苯酚与浓溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
①N2(g)+ O2(g)=2NO(g)△H=180.5 kJ/mol
②2C(s)+ O2(g)=2CO(g)△H=—221kJ/mol
③C(s)+ O2(g)=CO2(g)△H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式__________________。
(2)①用甲烷催化还原氮的氧化物可消除氮氧化物的污染CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH=QkJ·mol-1,写出上述反应的平衡常数表达式_______,已知该反应的平衡常数K随温度升高而减小,则Q_______0(填“>”或“<”或“=”)。
2N2(g)+CO2(g)+2H2O(g) ΔH=QkJ·mol-1,写出上述反应的平衡常数表达式_______,已知该反应的平衡常数K随温度升高而减小,则Q_______0(填“>”或“<”或“=”)。
②某温度下,密闭容器中CH4与NO的起始浓度分别为1mol/L、2mol/L,其中c(NO)随时间变化如图所示,t2时达到平衡,保持温度不变在t2时将容器容积压缩到一半,请画出t2-t3 c(CH4)随时间变化的曲线。_______

(3)①为提高反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)中的转化率,可以采取在恒压条件下充入稀有气体,解释其原因______________。
N2(g)+CO2(g)+2H2O(g)中的转化率,可以采取在恒压条件下充入稀有气体,解释其原因______________。
②电解吸收法处理氮氧化物废气的基本原理是用硝酸吸收氮氧化物生成NO2-,同时用石墨电极电解将NO2-转化成NO3-,电解条件下循环利用NO3-来处理氮氧化物。写出该法处理NO2总反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A为__.(填元素符号)
(2)D的最高价氧化物的水化物的化学式是__,用电子式表示C与D构成的化合物的形成过程__
(3)写出由A、B组成的化合物与E反应的化学方程式:____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016四川】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
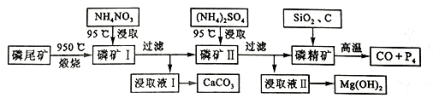
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com