
【题目】经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

(1)定性分析:
①如图甲可通过观察_____________________________________,定性比较得出结论。
②有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________,
③若H2O2在二氧化锰催化作用下发生反应,曾检测出有物质MnO3出现,写出整个反应过程的两个化学方程式:___________________________,________________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
【答案】 反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰 H2O2 +MnO2=MnO3+H2O 2MnO3=2MnO2+O2↑ 分液漏斗 收集40 mL气体所需要的时间
【解析】(1)①催化剂的不同会引起反应速率的不同,所以根据反应中产生气泡的快慢来定性分析催化剂的催化效果,故答案是:反应产生气泡的快慢。
②为了是实验具有可比性,应该使溶液中的阴离子也相同,这样才能排出阴离子不同可能组成的干扰。故答案是:控制阴离子相同,排除阴离子的干扰
H2O2在二氧化锰催化作用下发生反应,检测出有物质MnO3出现,二氧化锰作为催化剂,MnO3为中间主物,MnO2先转化为MnO3然后又生成为MnO2。整个反应过程的两个化学方程式:H2O2 +MnO2= MnO3+H2O ; 2MnO3= 2MnO2+O2↑。
(2)从外观分析A是分液漏斗,收集相同的体积,因此需要测量所用时间的长短。故答案为:分液漏斗,收集40mL气体所需要的时间。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁原子电池放电时电压高而平稳,电池反应为xMg+Mo3S4![]() MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
A. 放电时负极反应为Mg-2e-===Mg2+
B. 放电时Mg2+向正极区移动
C. 充电时阳极反应为Mo3S4+xMg2++2xe-===MgxMo3S4
D. 充电时电池的负极接充电电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.资料表明,SO2具有较强的还原性,能与高锰酸钾酸性溶液发生反应:5SO2+2![]() +2H2O===5
+2H2O===5![]() +2Mn2++4H+。
+2Mn2++4H+。
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的高锰酸钾酸性溶液反应。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
(1)该小组同学拟用如图所示装置定量分析空气中SO2的含量。
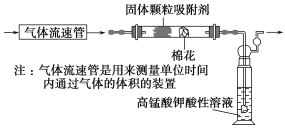
①通入空气前应进行的实验操作是________________________________;
②当观察到实验的现象为________________________________________时,应停止通空气;
③实验过程中需测量并记录的数据是_________________________________。
(2)如图表示该小组同学根据实验测得的该市不同地区空气中SO2的含量。
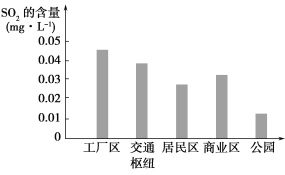
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________;
②请向当地有关部门提出一条减少工厂区SO2排放的建议:__________________________。
(3)下表是该小组同学测得的不同天气情况下的城市空气中SO2的平均含量。请分析雨后或风速较大时SO2平均含量较低的原因:
天气情况 | 平均风速(m·s1) | 空气中SO2的平均含量(mg·L1) |
雨前 | 2.0 | 0.03 |
雨后 | 2.2 | 0.01 |
晴 | 23 | 0.015 |
晴 | 0.9 | 0.03 |
①_____________________________________________________;
②_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:

(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是______________(填“较低温度”、“ 较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为_____;该温度下,反应的平衡常数K=__________;若要进一步提高甲醇积分数。可采取的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定盐酸、碳酸、硅酸的酸性强弱,设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。(提示:检验酸的酸性强弱可用强酸制取弱酸)

(1)锥形瓶中装某可溶性正盐,分液漏斗中所盛试剂应为________。
(2)装置B中所盛试剂是________________________________________,其作用是_____________。
(3)装置C中所盛试剂是___________________________________________,
C中反应的离子方程式是_________________________________________________。
(4)由此得到的结论是酸性:________>________>________。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则

A. M点所示溶液的导电能力强于Q点
B. N点所示溶液中c(CH3COO-)>c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com