
【题目】下列各组物质能用分液漏斗分离的是
A. 植物油和水的混合物 B. 含泥沙的食盐水
C. 乙醇的水溶液 D. 硫酸钡和氯化银的固体混合物
科目:高中化学 来源: 题型:
【题目】MnO2的一些性质或用途如图,下列说法正确的是( )

A. ①、②、③三个反应中MnO2均作氧化剂
B. 足量MnO2与2 L 10 mol/L HCl共热,可生成5 mol Cl2
C. 反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子
D. 反应③中K2CO3和KNO3的化学计量数均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:
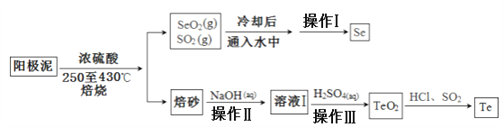
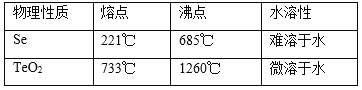
已知TeO2与Al2O3的化学性质相似,元素碲在溶液中主要以Te4+、TeO32-等形式存在;Se和TeO2的物理性质如下:
(1)加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎其目的是______________________。
(2)上述流程中操作仅为物理分离过程,其名称为___________,SeO2与SO2在冷水中反应的化学方程式___________________________。
(3)焙砂中碲以TeO2形式存在,写出氢氧化钠溶液与TeO2反应的离子方程式___________。
(4)向溶液Ⅰ中加入硫酸时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率_____________(填“偏高”、“偏低”或“无影响”)。
(5)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再通入二氧化硫得到碲单质,该过程中涉及到的反应类型有___________________________。
(6)上述流程中可循环利用的物质________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是( )
A.增大反应物浓度 B.减小反应容器的体积
C.增大生成物浓度 D.升高反应温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。
(1)常温下,可用铁或者铝制的容器盛放浓硝酸,说明浓硝酸具有_________ 性
A.酸性 B.强氧化性 C.吸水性 D.脱水性
(2)工业上用洗净的废铜屑作原料来制备硫酸铜。下列制备方法符合“绿色化学”思想的是_______________________________(填序号)。
① Cu + H2SO4(浓)![]() CuSO4 ② Cu
CuSO4 ② Cu![]() CuO
CuO![]() uSO4
uSO4
写出①中反应的化学方程式:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 甲、乙溶液均变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
甲基呋喃与氨在高温下反应得到甲基吡咯:

(1)Zn的基态原子核外电子排布式为 。配合物[Zn(NH3)3(H2O)]2+中,与Zn2+形成配位键的原子是 (填元素符号)。
(2)1 mol甲基呋喃分子中含有σ键的数目为 mol。
(3)甲基吡咯分子中碳原子轨道的杂化轨道类型是 。与NH3分子互为等电子体的阳离子为 。
(4)甲基吡咯的熔沸点高于甲基呋喃的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com