
分析 (1)利用盖斯定律,抵消中间产物,得到目的反应,计算△H;平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;方程式相加时,总平衡常数等于分方程的平衡常数之积;
(2)反应到达平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化;
(3)根据电荷守恒,判断离子浓度大小;氨水的电离平衡常数为电离出离子的浓度积与溶质浓度的比值;
(4)NH3不能与电解质反应及正极得到电子化合价升高.
解答 解:(1)利用盖斯定律,反应①×2+反应②+反应③,得到目的反应,△H=-91kJ•mol-1
+(-24kJ•mol-1)+(-41kJ•mol-1)=-247kJ•mol-1,
反应①×2+反应②+反应③相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K12•K2•K3,
故答案为:-247kJ•mol-1; K12•K2•K3;
(2)a、反应前后气体体积不同,当压强一定时,达到化学平衡状态,故a正确;
b、体系体积一定,反应前后气体质量相同,密度始终不变,不能判断是否平衡,故b错误;
c、CO和H2的物质的量保持不变,则其他各物质浓度亦保持不变,达到化学平衡状态,故c正确;
d、CO的消耗速率等于CO2的生成速率,均为正反应方向,不能判断是否平衡,故d错误;
故答案为:ac;
(3)写出电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液呈中性,即c(H+)=c(OH-),即c(NH4+)=c(Cl-);氨水中的电离常数为:$\frac{c(N{{H}_{4}}^{+})•c({H}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{y×1{0}^{-7}}{x-y}$=$\frac{1{0}^{-7}y}{x-y}$,
故答案为:=;$\frac{1{0}^{-7}y}{x-y}$;
(4)因NH3能与水反应,所以溶液呈碱性,因正极得到电子化合价升高,所以电极反应为:O2+2H2O+4e-=4OH-,
故答案为:碱性;O2+2H2O+4e-=4OH-.
点评 本题考查较为综合,涉及弱电解质的电离、电化学原理、盖斯定律等知识点,侧重考查学生运用化学原理解答问题能力,易错点是化学平衡状态判断,只有反应前后改变的物理量才能作为化学平衡状态判断依据.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:填空题
(1)3 mol二氧化碳气体中,约含有 个二氧化碳分子;2molNH4+中共有 mol电子,与之电子数相等的H2O的质量是 ,这些水若完全电解,产生的氢气在标准状况下的体积为 L。
(2)相同质量的氧气、氢气、二氧化碳中,含有分子数目最少的是 (填化学式,下同),标准状况下体积最大的是 ,原子数最少的是 。
(3)在NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2。如果混合液中共有0.5 mol Cl-,溶液的体积为0.5 L,则混合液中氯化钠的质量为 ;MgCl2的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
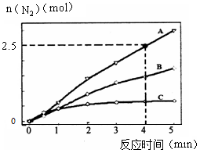 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
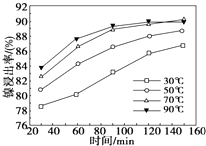 镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:
镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内气体颜色变浅,平均相对分子质量不变 | |
| B. | 平衡不移动,混合气体密度增大 | |
| C. | H2的转化率增大,HI平衡浓度变小 | |
| D. | 改变条件前后,速率图象如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com