
【题目】室温条件下,下列有关电解质溶液的描述正确的是( )
A.pH相同的氨水和Ba(OH)2溶液中:2c(NH4+)=c(Ba2+)
B.向Na2CO3溶液中通入CO2至溶液为中性,则 >1
>1
C.等浓度的KHSO3溶液与KOH溶液等体积混合:c (OH-)-c(H+)=c(HSO3-)+c(H2SO3)
D.向Mg (OH)2浊液中加入少量NH4Cl粉末![]() 不变
不变
【答案】B
【解析】
试题分析:A.pH相同的氨水和Ba(OH)2溶液中,根据电荷守恒可知c(NH4+)=2c(Ba2+),故A错误;B.向Na2CO3溶液中通入CO2后溶液中的电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),当溶液为中性时,c(Na+)=c(HCO3-)+2c(CO32-)>2c(CO32-),则![]() >1,故B正确;C.等浓度的KHSO3溶液与KOH溶液等体积混合得K2SO3溶液,存在的电荷守恒式为c(K+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),物料守恒式为c(K+)=2c(HSO3-)+2c(H2SO3)+2c(SO32-,可知c (OH-)-c(H+)=c(HSO3-)+2c(H2SO3),故C错误;D.向Mg (OH)2浊液中加入少量NH4Cl粉末,NH4+结合溶解平衡中的OH-生成NH3·H2O,促进溶解平衡正向移动,c(Mg2+)增大,c(OH-)减小,则
>1,故B正确;C.等浓度的KHSO3溶液与KOH溶液等体积混合得K2SO3溶液,存在的电荷守恒式为c(K+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),物料守恒式为c(K+)=2c(HSO3-)+2c(H2SO3)+2c(SO32-,可知c (OH-)-c(H+)=c(HSO3-)+2c(H2SO3),故C错误;D.向Mg (OH)2浊液中加入少量NH4Cl粉末,NH4+结合溶解平衡中的OH-生成NH3·H2O,促进溶解平衡正向移动,c(Mg2+)增大,c(OH-)减小,则![]() 增大,故D错误;答案为B。
增大,故D错误;答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示。则甲和X 不可能是

A. 甲为C,X为O2
B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2
D. 甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:

完成下列问题:
(1)该反应的化学方程式为_____________________。
(2)前2 min用A的浓度变化表示的化学反应速率为______________。
在2 min时,图像发生改变的原因可能是________(用字母表示)。
A.增大压强 B.降低温度
C.加入催化剂 D.增加A的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量: 。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量: 。
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量: 。
⑷已知下列反应的反应热为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+![]() O2(g)=H2O(l) △H3=-285.8kJ/mol
O2(g)=H2O(l) △H3=-285.8kJ/mol
试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知:

(a、b、c均大于零)
下列说法不正确的是
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C. 断开2 mol H—I键所需能量约为(c+b+a)kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(已知:2SO2(g)+O2(g)![]() 2SO3(g)△H=-196.6KJ·mol-1),恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。以下叙述错误的是( )
2SO3(g)△H=-196.6KJ·mol-1),恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。以下叙述错误的是( )

A.表示硫的燃烧热的热化学方程式:S(s)+O2(g)==SO2(g)ΔH=-297KJ·mol-1
B.由Ⅱ到Ⅲ的过程放出的热量为98.3KJ
C.恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值大于78.64KJ
D.将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸的叙述,错误的是( )
A.硅酸是一种很弱的酸
B.硅酸可由二氧化硅与水反应制得
C.硅酸不稳定,加热脱水会生成二氧化硅
D.硅酸可以由可溶性硅酸盐与盐酸反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化,吸附,絮凝于一体的新型多功能水处理剂,高铁酸盐热 稳定性差。制备方法有湿法、干法两种,其原理如下表所示:
湿法的生产工艺如下:
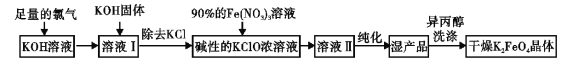
回答下列问题:
(1)K2FeO4 中Fe的化合价 ;实验室干法制备中选用的仪器是
A.蒸发皿 B.铁坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)在温度较高时KOH与Cl2反应生成的是KClO3,写出在温度较高时KOH与Cl2反应的化学方程式
___________________;
(3)在溶液 I 中加入KOH 固体的目的是
A.使 KClO3 转化为 KClO
B.为下一步反应提供碱性的环境
C.KOH 固体溶解放热,有利于提高反应速率
D.与溶液 I 中过量的 Cl2 继续反应,生成更多的 KClO
(4)向次氯酸钾强碱浓溶液中加入 90%的 Fe(NO3)3,发生反应的离子方程式为:
① Fe3++3OH-═Fe(OH)3;② 。
(5)用异丙醇代替蒸馏水洗涤湿产品,除能洗去杂质外,其优点有 。
(6)如何判断 K2FeO4 晶体已经洗涤干净 。
(7)高铁酸钾(K2FeO4)作为水处理剂的优点之一是能除去悬浮杂质,配平该反应的离子方程式:
____FeO42-+ H2O= Fe(OH)3(胶体)+ O2↑+ ( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com