
下列物质中含有共价键的是( )
|
| A. | HCl | B. | NaCl | C. | MgO | D. | KI |
| 共价键的形成及共价键的主要类型.. | |
| 专题: | 化学键与晶体结构. |
| 分析: | 一般来说,活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,第IA族、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,共价化合物只含共价键. |
| 解答: | 解:A.氯化氢中氯原子和氢原子之间只存在共价键,为共价化合物,故A正确; B.氯化钠中钠离子和氯离子之间只存在离子键,为离子化合物,故B错误; C.氧化镁中镁离子和氧离子之间只存在离子键,为离子化合物,故C错误; D.碘化钾中碘离子和钾离子之间只存在离子键,为离子化合物,故D错误; 故选A. |
| 点评: | 本题考查了离子键和共价键的判断,根据离子键和共价键的概念来分析解答,注意不能根据是否含有金属元素判断离子键、共价键,氯化铵中只含非金属元素,但铵根离子和氯离子之间存在离子键,为易错点. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ•mol﹣1.
Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)= 0.024mol•L﹣1•s﹣1 ,达平衡时N2的转化率= 20% .
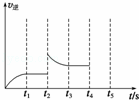
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是 升高了温度 、 增大了氨的浓度 (填写两项).
(3)下列哪些情况表明容器乙已达平衡状态 ACD (填字母).
A.容器乙中的气体密度不再变化
B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1mol N≡N键同时断裂6mol N﹣H键
D.容器乙中气体的平均相对分子质量不随时间而变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
可用于鉴别以下三种化合物的一组试剂是
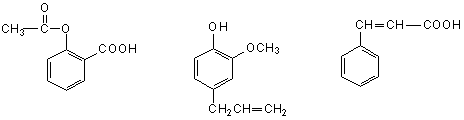
乙酰水杨酸 丁香酚 肉桂酸
① 银氨溶液 ② 溴的四氯化碳溶液 ③ 氯化铁溶液 ④ 氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是
 A.氯化钙的化学式 CaCl
A.氯化钙的化学式 CaCl
B. 镁离子结构示意图:
D.碳酸钠的电离方程式 Na2CO3=Na++CO32-
D.氢氧化钡的电离方程式Ba(OH)2= Ba2+ + 2 OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为__________。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为____________
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为____________
在一定条件下发生反应2SO2(g)+O2(g) 2SO3(g);
2SO3(g);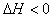
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com