
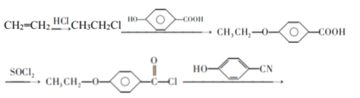
【题目】目前手机屏幕主要由保护玻璃、触控层以及下面的液晶显示屏三部分组成。下面是工业上用丙烯(A)和有机物C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:

(1)化合物C的官能团名称为____________________。B的结构简式为_____________。
(2)反应①的反应类型为_____________。
(3)写出C与过量NaHCO3水溶液反应的化学方程式______________________________。
(4)下列关于化合物D的说法正确的是__________(填字母)。
A.属于烯烃B.1molD最多能与4molH2发生加成反应
C.一定条件下发生缩聚反应D.核磁共振氢谱有6组峰
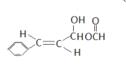
(5)满足下列条件下的D的同分异构体有多种,写出2个互为顺反异构的结构简式。顺式结构:_______________,反式结构_______________。
①能发生银镜反应和水解反应②存在手性碳原子
(6)请参照上述制备流程,写出以有机物C、乙烯和![]() 为原料制备
为原料制备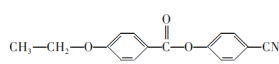 的合成路线流程图(无机试剂任用)___。
的合成路线流程图(无机试剂任用)___。
【答案】羧基、酚羟基 CH2=CH-CH2Br 取代反应 ![]() BD
BD 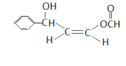
![]()
【解析】
丙烯(A)在有光的环境下反应生成B,发生取代反应,B为CH2=CHCH2Br,根据逆推可知,有机物C(C7H6O3)为苯环结构,取代基在对位,C为![]() ,B与C发生取代反应生成D,再与SOCl2发生取代反应,将羧基中的-OH取代为-Cl,最后再发生一次取代反应生成F。
,B与C发生取代反应生成D,再与SOCl2发生取代反应,将羧基中的-OH取代为-Cl,最后再发生一次取代反应生成F。
(1)C为![]() ,化合物C的官能团名称为羧基、酚羟基。B的结构简式为CH2=CH-CH2Br。
,化合物C的官能团名称为羧基、酚羟基。B的结构简式为CH2=CH-CH2Br。
(2)反应①碳碳双键不参与反应,甲基的氢被取代,反应类型为取代反应。
(3)写出C与过量NaHCO3水溶液反应,酚羟基不能反应,羧基能参与反应,化学方程式![]() 。
。
(4)化合物D含有碳碳双键和羧基,A.具有含氧官能团,不属于烯烃,A错误;
B.1molD最多能与4molH2发生加成反应,羧基不发生还原反应,B正确;
C.不发生缩聚反应,能发生加聚反应,C错误;
D.结构为对位取代,苯环有2组氢原子环境一致,核磁共振氢谱有6组峰,D正确;
答案为BD。
(5)D①能发生银镜反应和水解反应,说明具有-OOCH结构,②存在手性碳原子,说明存在碳原子的4个共价键连接的取代基不同,顺式结构: ,反式结构
,反式结构 。
。
(6)根据题中资料,根据逆推法可知,有机物C、乙烯和![]() 为原料制备
为原料制备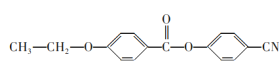 的合成路线流程图为
的合成路线流程图为
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ |
(1)⑤元素的原子结构示意图为_____________;
(2)③元素原子的最外层电子数为___________;
(3)⑤元素与④元素形成的离子化合物的化学式为_________(写出一种即可);
(4)②、③、④三种元素的非金属性逐渐___________(填“减弱”或“增强”);
(5)④元素和⑥元素形成的氢化物,其稳定性的强弱顺序为_______>_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示各步变化,A为金属,B为淡黄色固体,且每一物质均含有A元素。

(1)试推断以下物质:
B.____________,C.____________,D.____________,E.____________(填化学式)。
(2)写出B→C的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素原子序数依次喊小,原子半径的大小关系为:r(Y)>r(X)>r(Z), 三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )

A. X元素位于ⅥA族 B. A难溶于B中
C. A和C不可能发生氧化还原反应 D. B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a克块状碳酸钙与足量盐酸反应,固体反应物消耗的质量m随时间t的变化曲线如下图实线所示。在相同条件下,将b克(a>b)粉末状碳酸钙与足量的溶质质量分数相等的盐酸反应,则相应的曲线(图中虚线所示)正确的是 ( )
A.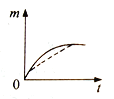 B.
B.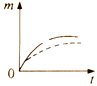 C.
C.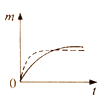 D.
D.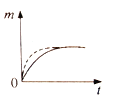
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
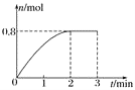
A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)p电子的原子轨道呈______形;
(2)共价键的类型有两种分别是σ键和π键,σ键的对称方式为______;
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是______,最高价氧化物对应的水化物的化学式______;
(4)用“>”或“<”填空:①能量:4p______5s②离子半径:F-______Na+;
(5)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。
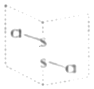
①S2Cl2的结构式为______,其化学键类型有______(填“极性键”“非极性键”或“极性键和非极性键”)。
②电负性:S______Cl(填“>”或“<”),每个S原子有______对弧电子对。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氮肥厂氨氮废水中的氮元素多以NH4+和NH3![]() H2O的形式存在,该废水的处理流程如下:
H2O的形式存在,该废水的处理流程如下:
![]()
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:____________。
②用化学平衡原理解释通空气的目的:__________。
(2) 过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
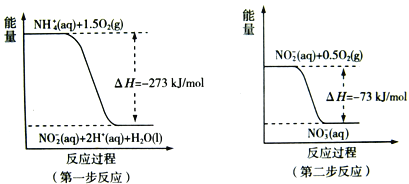
①第一步反应是_________反应(选题“放热”或“吸热”),判断依据是__________。
②1mol NH4+(aq)全部氧化成![]() 的热化学方程式是______________。
的热化学方程式是______________。
(3) 过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗![]() 转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是__________。
转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为![]() ,其相对分子质量为M。25℃时,a g该晶体能够溶于b g水中形成VmL饱和溶液。下列关系中不正确的是( )
,其相对分子质量为M。25℃时,a g该晶体能够溶于b g水中形成VmL饱和溶液。下列关系中不正确的是( )
A.该溶液的密度ρ=![]()
B.该溶液的物质的量浓度为![]()
C.该溶液中溶剂与溶质的质量比为m(溶剂):m(溶质)=![]()
D.该溶液中溶质的质量分数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com