
| A. | 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y). | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | X与其余三种元素之间形成的核外电子总数为10的微粒只有2种 | |
| D. | H2Z的熔点比H2W高,是因为它们的晶体类型不同 |
分析 X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,在元素周期表中,Z与Y、W均相邻,Y、Z、W三种元素的原子最外层电子数之和为17,若Y、Z、W三者处于同一周期或同一主族,最外层电子数之和不可能为17,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: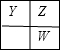 、
、 ,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分别位于不同周期,则X为H元素,据此解答.
,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分别位于不同周期,则X为H元素,据此解答.
解答 解:X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,在元素周期表中,Z与Y、W均相邻,Y、Z、W三种元素的原子最外层电子数之和为17,若Y、Z、W三者处于同一周期或同一主族,最外层电子数之和不可能为17,处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有: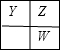 、
、 ,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分别位于不同周期,则X为H元素.
,设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分别位于不同周期,则X为H元素.
A.所有元素中H原子半径最小,同周期元素从左到右原子半径逐渐减小,一般电子层越多原子半径越大,故原子半径:r(X)<r(Z)<r(Y)<r(W),故A错误;
B.X、Y、Z可形成的化合物可为HNO3或NH4NO3等,前者为共价化合物,后者为离子化合物,故B正确;
C.H与其余三种元素之间形成的核外电子总数为10的微粒有NH3、NH4+、OH-、H2O、H3O+等,故C错误;
D.H2O、H2S都形成分子晶体,但H2O分子之间存在氢键,其沸点比H2S高,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,注意把握原子结构特点以及元素在周期表中的位置,侧重于学生的分析能力的考查,为高考常见题型,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
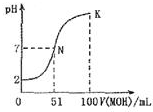 常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是
常温下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计).下列说法中不正确的是| A. | MOH为一元弱碱 | |
| B. | MA 稀溶液PH<7 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液的PH=10,则C(MOH)+C(OH)-C(H+=0.01mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
| A. | 放电时,电极A为负极 | |
| B. | 根据上表数据,请你判断该电池工作的适宜温度应控制在350℃~2050℃ | |
| C. | 放电时,Na+的移动方向为从电极A到电极B | |
| D. | 充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
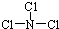 ,X 与水反应的化学方程式是NCl3+3H2O═NH3+3HClO.
,X 与水反应的化学方程式是NCl3+3H2O═NH3+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
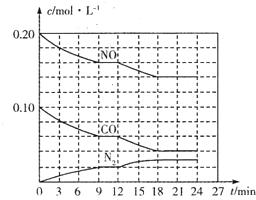 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠钾合金可用作快中子反应堆导热剂的原因之一是常温下呈液态 | |
| B. | 我国航天员穿的航天服使用的高强度、高韧性的特种尼龙,是一种有机高分子合成材料 | |
| C. | 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 | |
| D. | 用氢作汽车燃料,用燃料电池作动力,合成可再生的储氢材料,可以实现汽车的“零排放” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③⑥ | C. | ①③ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com