
 ,乙烯通入溴水中,现象是溴水褪色,这一反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br,白酒的主要成分的化学名称是乙醇,乙酸的结构简式:CH3COOH,醇的官能团名称是羟基,羧酸的官能团名称是羧基,羧酸和醇二者在一定条件下发生反应的类型是酯化反应(或取代反应);苯的空间结构为平面正六边型结构,常温下为液态.
,乙烯通入溴水中,现象是溴水褪色,这一反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br,白酒的主要成分的化学名称是乙醇,乙酸的结构简式:CH3COOH,醇的官能团名称是羟基,羧酸的官能团名称是羧基,羧酸和醇二者在一定条件下发生反应的类型是酯化反应(或取代反应);苯的空间结构为平面正六边型结构,常温下为液态. 分析 甲烷的分子式为CH4,可与氯气发生取代反应,乙烯含有碳碳双键,可发生加成、加聚和氧化反应,乙酸含有羧基,具有酸性,可发生酯化反应,苯为平面形结构,常温下为液态,以此解答该题.
解答 解:甲烷的分子式为CH4,可与氯气发生取代反应,生成的有机物有4种,乙烯含有碳碳双键,电子式为 ,乙烯与溴水发生加成反应,溴水褪色,方程式为CH2=CH2+Br2→CH2Br-CH2Br,白酒的主要成分为乙醇,乙酸含有羧基,结构简式为CH3COOH,具有酸性,醇的官能团为羟基,羧酸的官能团为羧基,醇与酸发生酯化反应,苯为平面形结构,常温下为液态,
,乙烯与溴水发生加成反应,溴水褪色,方程式为CH2=CH2+Br2→CH2Br-CH2Br,白酒的主要成分为乙醇,乙酸含有羧基,结构简式为CH3COOH,具有酸性,醇的官能团为羟基,羧酸的官能团为羧基,醇与酸发生酯化反应,苯为平面形结构,常温下为液态,
故答案为:CH4;4; ;溴水褪色; CH2=CH2+Br2→CH2Br-CH2Br;乙醇; CH3COOH;羟基;羧基; 酯化反应(或取代反应);平面正六边;液.
;溴水褪色; CH2=CH2+Br2→CH2Br-CH2Br;乙醇; CH3COOH;羟基;羧基; 酯化反应(或取代反应);平面正六边;液.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的结构和官能团的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | B. | Al2O3+3C$\frac{\underline{\;高温\;}}{\;}$2Al+3CO↑ | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
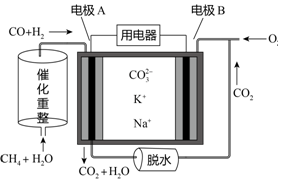
| A. | 电极A上H2和CO都发生了氧化反应 | |
| B. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| C. | 电池工作时,电能转变为化学能 | |
| D. | 电极B上发生的电极反应为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
| D | 漂白粉 | 氨水 | 氯化钠 | 次氯酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气体中NO在标准状况下的体积可能为16.8 L | |
| B. | 所得溶液中NaNO3和NaNO2的物质的量之比可能为1:2 | |
| C. | 若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L | |
| D. | 在用氨气处理氮氧化物时,氮氧化物发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com