
 2HI��ƽ����ϵ����ѹ���ܱ���ϵ�еĻ�������ܶ�����
2HI��ƽ����ϵ����ѹ���ܱ���ϵ�еĻ�������ܶ�����| A���٢ۢ� | B���ڢޢ� | C���ۢܢ� | D���ڢۢ� |
 Fe��OH��3+3HCl�������ˮ�����ȣ������¶�ƽ�������ƶ��������ӷ������������������壬������ɳ����ԭ�����ͣ������ڳ�ʪ�Ŀ��������γ�ԭ��أ��ӿ츯ʴ����������ɳ����ԭ�����ͣ���NaHSO4��Һ��ˮϡ�ͣ��漰ˮ�ĵ���ƽ���ƶ���������ɳ����ԭ�����ͣ��ܳ����£�������Һ���ڵ���ƽ�⣺CH3COOH
Fe��OH��3+3HCl�������ˮ�����ȣ������¶�ƽ�������ƶ��������ӷ������������������壬������ɳ����ԭ�����ͣ������ڳ�ʪ�Ŀ��������γ�ԭ��أ��ӿ츯ʴ����������ɳ����ԭ�����ͣ���NaHSO4��Һ��ˮϡ�ͣ��漰ˮ�ĵ���ƽ���ƶ���������ɳ����ԭ�����ͣ��ܳ����£�������Һ���ڵ���ƽ�⣺CH3COOH CH3COO-+H+��ˮϡ�ͣ�ƽ�������ƶ���������ɳ����ԭ�����ͣ���Na2CO3��Һ����CO32-��ˮ��ƽ�⣺CO32-+H2O
CH3COO-+H+��ˮϡ�ͣ�ƽ�������ƶ���������ɳ����ԭ�����ͣ���Na2CO3��Һ����CO32-��ˮ��ƽ�⣺CO32-+H2O  HCO3-+OH-����CaCl2��Һ�������Ӻ�̼�����Ӧ����̼��Ƴ�����ʹƽ�������ƶ���������ɳ����ԭ�����ͣ�����H2+I2
HCO3-+OH-����CaCl2��Һ�������Ӻ�̼�����Ӧ����̼��Ƴ�����ʹƽ�������ƶ���������ɳ����ԭ�����ͣ�����H2+I2 2HI��ƽ����ϵ����ѹ��ƽ�ⲻ�ƶ�����������ɳ����ԭ�����ͣ�����˫��ˮ�ķֽ�ʵ���м�MnO2��������ʹ�ֽ����������ӿ죬��������ɳ����ԭ�����ͣ���������ѡB��
2HI��ƽ����ϵ����ѹ��ƽ�ⲻ�ƶ�����������ɳ����ԭ�����ͣ�����˫��ˮ�ķֽ�ʵ���м�MnO2��������ʹ�ֽ����������ӿ죬��������ɳ����ԭ�����ͣ���������ѡB��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3������ƽ����ϵ�и����ʵ�Ũ�ȶ����ӵ�ԭ����2����������Ľ����
2NH3������ƽ����ϵ�и����ʵ�Ũ�ȶ����ӵ�ԭ����2����������Ľ����| A��ƽ�ⲻ�����ƶ����� | B��ƽ�������淴Ӧ�����ƶ� |
| C�����淴Ӧ���ʶ����� | D��NH3�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��
2NH3��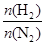 ��ʾ��ʼʱH2��N2�����ʵ���֮�ȣ�����ʼʱH2��N2�����ʵ���֮����ȡ�����ͼ����ȷ����(����)
��ʾ��ʼʱH2��N2�����ʵ���֮�ȣ�����ʼʱH2��N2�����ʵ���֮����ȡ�����ͼ����ȷ����(����)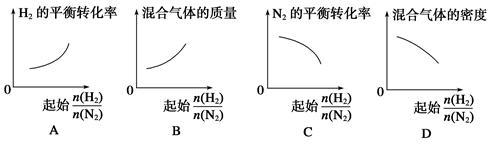
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ϊ����������n(NH3)=1.2mol | B����Ϊ��ѹ������n(NH3) >1.2mol |
| C����Ϊ����������n(NH3)>1.2mol | D����Ϊ��ѹ������n(NH3)<1.2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NO2��ͨ��18O��ɵ����������´ﵽƽ�����18O
2NO2��ͨ��18O��ɵ����������´ﵽƽ�����18O| A��ֻ������O2�� |
| B��ֻ������NO2�� |
| C��ֻ������O2��NO2�� |
| D��������NO��O2��NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)����Ӧ�ﵽƽ��ı������������ٴδﵽƽ�⣬NH3Ũ����ԭƽ�ⲻͬ����
2NH3(g)����Ӧ�ﵽƽ��ı������������ٴδﵽƽ�⣬NH3Ũ����ԭƽ�ⲻͬ���� | A�������¶Ⱥ�ѹǿ���䣬����1 mol NH3(g) |
| B�������¶Ⱥ�������䣬����1 mol Ar(g) |
| C�������¶Ⱥ�ѹǿ���䣬����1 mol N2(g) ��3mol H2 (g) |
| D�������¶Ⱥ�ѹǿ���䣬����1 mol Ar(g) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g),��Ӧ��ƽ��ʱ�������������A��B�����ʵ���֮����C�����ʵ�����ȣ�����ʱA��ת����Ϊ�� ��
2C(g),��Ӧ��ƽ��ʱ�������������A��B�����ʵ���֮����C�����ʵ�����ȣ�����ʱA��ת����Ϊ�� ��| A��40% | B��50% | C��60% | D��70% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 I2(g)+H2(g)�����������ܹ�˵���Ѵﵽƽ��״̬����
I2(g)+H2(g)�����������ܹ�˵���Ѵﵽƽ��״̬����| A�������ʵ�����Ũ�ȱ�2 : 1: 1 |
| B�������ڵ���ѹ����ʱ��仯 |
| C������2 mol H��I����ͬʱ����1 mol I��I�� |
| D������������ɫ���ٱ仯ʱ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2+I2(g)���ܱ�������װ��1molHI������һ��������ʹ���ֽ⣬��֪��35%�����ֽ⣬�������ڻ������������ʵ�����
H2+I2(g)���ܱ�������װ��1molHI������һ��������ʹ���ֽ⣬��֪��35%�����ֽ⣬�������ڻ������������ʵ�����| A��1mol | B��0.5mol | C��1.5mol | D��2mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com