
| 元素代号 | X | Y | Z | M | N | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 1.02 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +6 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -2 | -3 | -2 | |
| A. | 气态氢化物的稳定性:N>Y | |
| B. | M(OH)2的碱性比XOH的碱性强 | |
| C. | 元素X和Q形成的化合物只可能有离子键 | |
| D. | X、Z、N的最高价氧化物对应的水化物之间可两两相互反应 |
分析 短周期元素中,N、Q都有+6价,而N有+6价,且原子半径较大,故N为硫元素、Q为氧元素;Y有+7、-1价,则Y为Cl;R元素化合价为+5、-3,Z处于ⅤA族,原子半径小于Cl,故R为氮元素;X、Z、M的化合价分别为+1、+3、+2,分别处于IA、ⅢA、ⅡA族,原子半径均大于硫,且X>M>Z,故X为Na、M为Al、Z为Mg,据此解答.
解答 解:短周期元素中,N、Q都有+6价,而N有+6价,且原子半径较大,故N为硫元素、Q为氧元素;Y有+7、-1价,则Y为Cl;R元素化合价为+5、-3,Z处于ⅤA族,原子半径小于Cl,故R为氮元素;X、Z、M的化合价分别为+1、+3、+2,分别处于IA、ⅢA、ⅡA族,原子半径均大于硫,且X>M>Z,故X为Na、M为Al、Z为Mg.
A.同周期自左而右非金属性增强,氢化物稳定性与元素非金属性一致,故稳定性HCl>H2S,故A错误;
B.金属性Mg<Na,故碱性:Mg(OH)2<NaOH,故B错误;
C.元素X和Q形成的化合物中Na2O2含有离子键、共价键,故C错误;
D.X、Z、N的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝、硫酸,氢氧化铝属于两性氢氧化物,能与氢氧化钠、硫酸反应,氢氧化钠与硫酸发生中和反应,故D正确;
故选D.
点评 本题考查位置结构性质的关系及应用,题目难度中等,关键是根据原子半径和元素的化合价推断元素,注意对元素周期律的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 利用15N可以测定亚硝酸盐对地下水质的污染情况.
利用15N可以测定亚硝酸盐对地下水质的污染情况. ,15N2的结构式为15N≡15N;
,15N2的结构式为15N≡15N;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2不能完全转化为SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓度都为0.1mol•L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 | |
| C. | 向浓度都为0.1mol•L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应 | |
| D. | 向0.1mol•L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,FeS2中的硫元素全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
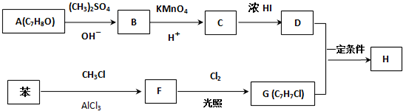

 .
. .
. .
. .
.

 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
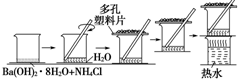 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
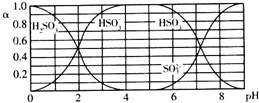
| A. | 溶液的pH=5时,硫元素的主要存在形式为HSO3- | |
| B. | 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) | |
| C. | 向pH=8的上述溶液中滴加少量澄清石灰水,$\frac{{c({HSO_3^-})}}{{c({SO_3^{2-}})}}$的值增大 | |
| D. | 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com