
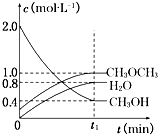
 ��1��һ�������£�NO��NO2�������з�Ӧ��NO��g��+NO2��g��?N2O3��g������ƽ�ⳣ������ʽΪK=
��1��һ�������£�NO��NO2�������з�Ӧ��NO��g��+NO2��g��?N2O3��g������ƽ�ⳣ������ʽΪK=| ת������ |
| ��ʼ������ |
| c(N2O3) |
| c(NO)?c(NO2) |
| c(N2O3) |
| c(NO)?c(NO2) |
| c(N2O3) |
| c(NO)?c(NO2) |
| 1��0.8 |
| 0.42 |
| ת������ |
| ��ʼ������ |
| 2.0-0.4 |
| 2.0 |
| 0.6��1.2 |
| 0.42 |
| 32g |
| 32g/mol |
| 6mol |
| 8 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t/s | 2 | 4 | 7 | 9 |
| n��Y��/mol | 0.12 | 0.10 | 0.09 | 0.09 |
| A����Ӧǰ2s��ƽ������v��Z��=2.0��10-3 mol/��L?s�� |
| B�������������䣬����һ������Y����Ӧ����һ���ӿ� |
| C����Ӧ����4sʱ��X��ת����75% |
| D����Ӧ�ﵽƽ��ʱ��X�����ʵ���Ũ��Ϊ0.02mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ǻ����л���һ�����ڴ��� |
| B����������ͬ��������һ��ѡ���̼����Ϊ���� |
| C�������ܷ�����ȥ��Ӧ |
| D�������ܷ���ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£�A�ǿ�����������ˮ���������Ļ���ɫ�������壬A��B��C��D��E����XԪ�أ���ת����ϵ��ͼ��ʾ��
�����£�A�ǿ�����������ˮ���������Ļ���ɫ�������壬A��B��C��D��E����XԪ�أ���ת����ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
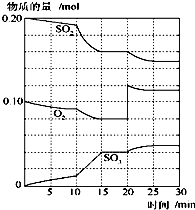 ��1����һ���¶Ⱥ�ѹǿ�£������·�Ӧ��2SO2��g��+O2��g�� 2SO3��g������1.6molSO2��0.8mol��O2����һ����ɱ���ܱ������У������������ʼ�ݻ�Ϊ100L����һ��ʱ���Ӧ�ﵽƽ�⣬��û��������ܶ�Ϊ1.6g?L-1����ش��������⣺
��1����һ���¶Ⱥ�ѹǿ�£������·�Ӧ��2SO2��g��+O2��g�� 2SO3��g������1.6molSO2��0.8mol��O2����һ����ɱ���ܱ������У������������ʼ�ݻ�Ϊ100L����һ��ʱ���Ӧ�ﵽƽ�⣬��û��������ܶ�Ϊ1.6g?L-1����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ƻ����ˮ�� |
| B���Ʋ����ۻ� |
| C����������ը |
| D����ʹˮ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com