
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。负极反应式为________________________________;反应一段时间后负极的质量_________(填“增重”或“减少”或“不变”)
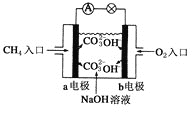
(2)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,该电池极的负电极反应式是:________________________;标准状况下,2.24L的甲烷全部反应后,电子转移________ mol。
(3)将铝片和铜片用导线相连,分别插入浓硝酸中(a组)和插入烧碱溶液中(b组),都形成了原电池,在a组原电池中,负极材料为______;写出b组插入烧碱溶液中形成原电池的负极反应式:_________________________。
【答案】 Pb+SO42-–2e-=PbSO4 增重 CH4+10OH-–8e-=CO32—+7H2O 0.8 Cu Al+4OH-–3e-=AlO2-+2H2O
【解析】(1)根据总方程式可知负极是Pb失去电子转化为硫酸铅,反应式为Pb+SO42-–2e-=PbSO4,因此反应一段时间后负极的质量增重;(2)甲烷在负极通入,发生失去电子的氧化反应,电解质溶液显碱性,则该电池极的负电极反应式是CH4+10OH-–8e-=CO32—+7H2O;标准状况下,2.24L的甲烷是0.1mol,全部反应后,电子转移0.8mol。(3)常温下铝在浓硝酸中钝化,将铝片和铜片用导线相连,插入浓硝酸中铝是正极,铜是负极;铝能与氢氧化钠溶液反应,所以插入烧碱溶液中铝是负极,负极反应式为Al+4OH-–3e-=AlO2-+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物F可用于制造香精,可利用下列路线合成。

回答下列问题:
(1)![]() 分子中可能共面的原子最多有_____个;
分子中可能共面的原子最多有_____个;
(2)物质A的名称是______;
(3)物质D中含氧官能团的名称是_______;
(4)“反应④”的反应类型是______;
(5)写出“反应⑥”的化学方程式:________;
(6)C有多种同分异构体,与C中所含有的官能团相同的有_____种,其中核磁共振氢谱为四组峰的结构简式为 和_______。
和_______。
(7)参照上述合成路线,以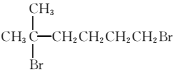 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:_______________。
的合成路线:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在,我们把无污染.无公害的食品叫做绿色食品。而最初,专家把绿色植物通过光合作用转化的食品叫做绿色食品,海洋提供的食品叫做蓝色食品,通过微生物发酵制得的食品叫做白色食品。根据最初的说法,下列属于绿色食品的是( )
A. 大米 B. 海带 C. 食醋 D. 食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,在科学上没有错误的是
A. 吸带过滤嘴的香烟,对人体无害
B. 保护环境就是保护人类自己
C. 纯天然物质配成的饮料,不含任何化学物质
D. 水可以变为油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B. 25℃时,等体积等物质的量浓度的硝酸与氨水混合后,溶液pH=7
C. 25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D. 25℃时,pH=2的酸HA溶液与pH=12的玻BOH溶液等体积混合后,所得溶液呈酸性,证明HA为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H7Br 的有机物,不可能是
A. 只含有1个双键的直链有机物 B. 含有2个双键的直链有机物
C. 含有1个双键的环状有机物 D. 含有1个叁键的直链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )
A. N2、H2完全转化为NH3 B. N2、H2、NH3在容器中共存
C. 反应已达到化学平衡状态 D. N2、H2、NH3的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成是目前普遍使用的人工固氮方法。
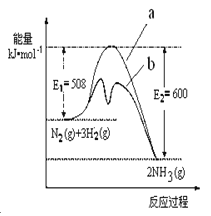
(1) 根据图提供的信息,写出该反应的热化学方程 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
(2) 在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com