
【题目】【化学——选修3:物质结构与性质】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。请回答:
(1)科学研究表明用TiO2作光催化剂可将废水中CN转化为OCN、并最终氧化为N2、CO2。OCN—中三种元素的第一电离能由大到小的顺序为。与OCN互为等电子体的一种分子为(填化学式)。
(2)Ti(BH4)2是一种储氢材料。写出基态Ti2+的电子排布式 , BH4中B原子的杂化轨道类型是。
(3)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为;
已知CrO5中Cr为+6价,则CrO5的结构式为。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4 , 该物质晶胞呈正四面体构型。试推测Ni(CO)4的晶体类型为 , Ni(CO)4易溶于下列(填选项字母)中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(5)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO FeO(填“>”或“<”),原因为。
(6)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数为;若该晶胞密度为ρ g·cm3 , 硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为pm。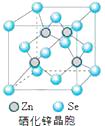
【答案】
(1)N>O>C;CO2、N2O等
(2)1s22s22p63s23p63d2(或[Ar]3d2);sp3
(3)6;![]()
(4)分子晶体;BC
(5)>;r(Ni2+)小于r(Fe2+),NiO的晶格能大于FeO
(6)4;![]()
×1010pm
【解析】解:(1)OCN-中三种元素是同周期元素,N原子2p轨道半满为相对稳定结构第一电离能最大,所以C、N、O的第一电离能为N>O>C;与OCN-互为等电子体的一种分子为CO2、N2O等; (2)基态Ti2+的电子排布式为1s22s22p63s23p63d2(或[Ar]3d2),BH4
中B原子的杂化轨道类型是sp3。(3)[Cr(H2O)4Cl2]Cl·2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6, CrO5中存在过氧键、Cr-O键、Cr=O键,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为 ![]() (4) Ni(CO)4是易挥发液体,晶胞为正四面体形,所以Ni(CO)4为分子晶体,根据相似相溶原理,则Ni(CO)4易溶于有机溶剂,所以答案选BC.(5)、r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则r(Ni2+)<r(Fe2+),阴离子都是氧离子,所以阳离子半径小的晶格能大,则熔点高,所以NiO的熔点大于FeO;Mn2+的价电子排布为3d5 , 3d轨道半充满,较稳定,由较稳定的3d5半充满态转为不稳定的3d4状态需要的能量较多,Fe2+的价电子为3d6,不稳定,由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。(6)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为:
(4) Ni(CO)4是易挥发液体,晶胞为正四面体形,所以Ni(CO)4为分子晶体,根据相似相溶原理,则Ni(CO)4易溶于有机溶剂,所以答案选BC.(5)、r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则r(Ni2+)<r(Fe2+),阴离子都是氧离子,所以阳离子半径小的晶格能大,则熔点高,所以NiO的熔点大于FeO;Mn2+的价电子排布为3d5 , 3d轨道半充满,较稳定,由较稳定的3d5半充满态转为不稳定的3d4状态需要的能量较多,Fe2+的价电子为3d6,不稳定,由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。(6)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为: ![]() ,含有锌原子数为4,根据
,含有锌原子数为4,根据 ![]() ,所以
,所以 ![]() ,则晶胞的边长为
,则晶胞的边长为 ![]() ×cm=
×cm= ![]() ×1010pm。
×1010pm。
【考点精析】掌握晶体的类型与物质熔点、硬度、导电性等的关系是解答本题的根本,需要知道不同晶体类型的物质:原子晶体>离子晶体>分子晶体;同种晶体类型的物质:晶体内微粒间的作用力越大,溶、沸点越高.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按系统命名法填写下列有机物的名称及有关内容:
(1)![]() ,名称是 .
,名称是 .
(2)![]() 名称是 , 1mol该烃完全燃烧,需消耗氧气mol.
名称是 , 1mol该烃完全燃烧,需消耗氧气mol.
(3)![]() 名称是
名称是
(4)![]() 名称是
名称是
(5)CH3CH(CH3)C(CH3)2(CH2)2CH3名称是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分是Cu2S)是冶炼铜的主要原料,辉铜矿样品的纯度可以用酸性高锰酸钾溶液滴定来测定,该反应可表示为Cu2S+ ![]() +H+→Cu2++
+H+→Cu2++ ![]() +Mn2++H2O(未配平)。下列说法中不正确的是( )
+Mn2++H2O(未配平)。下列说法中不正确的是( )
A.Cu2S为还原剂被氧化, ![]() 为氧化剂被还原
为氧化剂被还原
B.氧化剂和还原剂物质的量之比为2∶1
C.反应中每消耗1 mol Cu2S,转移8 mol电子
D.滴定时可以不加其他的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物能用溶解、过滤、蒸发三步操作分离的是( )
A. 水和酒精的混合物B. 食盐和蔗糖的混合物
C. 氯化钾和氯化银的混合物D. 硫酸钡和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如图所示.下列因素中,可能影响该反应的反应速率的因素是( )
①盐酸的浓度 ②镁条的表面积③溶液的温度 ④Cl﹣的浓度.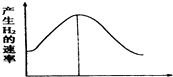
A.①④
B.③④
C.①②③
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在pH=11的某溶液中,由水电离的c(OH﹣)为( )
①1.0×10﹣7 molL﹣1 ②1.0×10﹣6 molL﹣1
③1.0×10﹣3 molL﹣1 ④1.0×10﹣11 molL﹣1 .
A.③
B.④
C.①或③
D.③或④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( ) 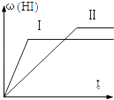
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向滴有酚酞的水中加入过量Na2O2粉末并振荡,下列实验现象中正确的是 ( )
①溶液始终呈现无色②溶液由无色变红又变无色③溶液中有气泡产生④溶液由无色变为红色
A. ①③B. ①②C. ②③D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com