
【题目】固体氧化物燃料电池(SOFC)以固体氧化物(能传导O2-)作为电解质,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是( )

A. 电极b为电池负极,电极反应式为O2+4e-=2O2-
B. 固体氧化物的作用是让电子在电池内通过
C. 若H2作为燃料气,接触面上发生的反应为:H2+2OH-—4e-=2H++H2O
D. 若C2H4作为燃料气,接触面上发生的反应为:C2H4+6O2-—12e-=2CO2+2H2O
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据见下图,下列说法正确的是

A. Bi元素的质量数是83 B. Bi元素的相对原子质量是209.0
C. Bi原子6p能级有一个未成对电子 D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:

(1)F装置的烧杯中发生反应的离子方程式是 ;B装置中的现象是 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+![]()
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol·![]() 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
(已知![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )

A. B中导气管里形成一段水柱
B. B中导气管中产生气泡
C. 金属片剪口处溶液变红
D. 锌被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】父亲节快到了!同学们议论着给父亲一个节日礼物,大家的提议集中在不锈钢领带别针、纯棉T恤、玻璃水杯和碳纤维增强网球拍。下列关于礼物材料的说法正确的是
A. 纯棉T恤是复合材料制品 B. 不锈钢领带别针是有机材料制品
C. 玻璃水杯是无机材料制品 D. 碳纤维增强网球拍是无机材料制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
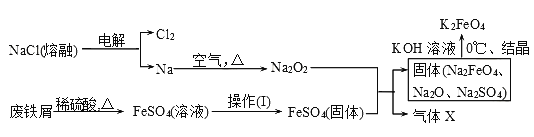
(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_____________________________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是_________________________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。

A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com