
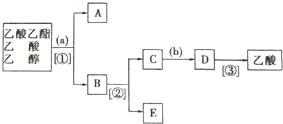
分析 由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,以此来解答.
解答 解:乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,即①为分液.A为乙酸乙酯,B为碳酸钠溶液,吸收乙醇、除去乙酸,对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇,则②为蒸馏.然后C中水层含乙酸钠,根据强酸制弱酸,要用b(浓硫酸)反应得到乙酸,再③蒸馏得到乙酸,
由上述分析可知,试剂a为饱和Na2CO3溶液,b为H2SO4,分离方法①、②、③分别为分液、蒸馏、蒸馏,
故答案为:饱和Na2CO3溶液;分液;蒸馏;H2SO4;蒸馏.
点评 本题考查混合物分离提纯,为高频考点,把握混合物分离流程、分离方法及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 液氯是纯净物,而氯水是混合物 | B. | 液氯有酸性,氯水有漂白性 | ||
| C. | 液氯较氯水的漂白作用更强 | D. | 液氯无色,氯水呈黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
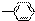 、-OH、-COOH五种原子或原子团中的任意两种,两两组合形成的物质中,溶液显酸性的物质有( )
、-OH、-COOH五种原子或原子团中的任意两种,两两组合形成的物质中,溶液显酸性的物质有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 | |
| C. | 元素周期律是元素原子核外电子排布周期性变化的结果 | |
| D. | 形成离子键的阴、阳离子间只存在静电吸引力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
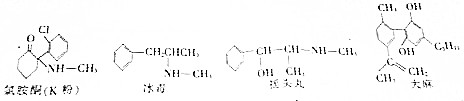
| A. | 盐 | B. | 氧化物 | C. | 有机物 | D. | 油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com