
| A. | ①③ | B. | ③② | C. | ③① | D. | ①②③ |
科目:高中化学 来源: 题型:解答题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
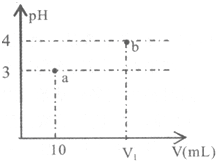
| A. | 若V1=100,则稀释前A的浓度一定是0.001mol/L | |
| B. | 若A为NH4Cl和HCl的混合溶液,则V1一定大于100 | |
| C. | a点水的电离程度一定小于b点 | |
| D. | 若A为NH4Cl和NH3•H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(CO)=v逆(H2O) | |
| B. | 2 mol H-O键断裂的同时有1 mol H-H键形成 | |
| C. | 生成n mol CO的同时生成n mol H2O(g) | |
| D. | 体系的压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g)△H<0其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大 | |
| B. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| C. | 合成氨反应是放热反应,所以工业合成氨时温度越低越好 | |
| D. | 恒温、恒容的条件下对于N2(g)+3H2(g)?2NH3(g)△H<0的反应,混合气体的平均相对分子质量不变可以作为其达到化学平衡状态的标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 1mol氯气跟足量的NaOH溶液完全反应,转移的电子数为2NA | |
| C. | 1mol Na2O含离子数为3NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com