
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
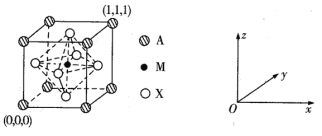
则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
【答案】[Ar]3d24s2 激发 Li<B<Be Si2H4、Si3H6 SiH4 原子半径Si>C,Si-Si长度大于C-C,键能较小,键的稳定性较差,不利于形成长链 随着相对分子质量的增大而升高 12 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)钛是22号元素。从左到右,第一电离能增大;
(2)硅原子最外层有4个电子,乙硅烯、丙硅烯分子中,均有硅原子形成了3个σ键;
(3)观察晶胞图知,顶点A紧邻等距离最近的X位于晶胞的三个平面,即横平面、正平面和侧平面,将每个平面扩展,则每个平面中距离A最近的X均有4个,故共有3×4=12个。
(1)钛是22号元素,电子排布式为[Ar]3d24s2。基态钙原子的20个电子分占6个不同的能级,即电子有6种能量状态,现在有7种能量状态,说明它处于激发态。从左到右,第一电离能增大,Be (2s2) s能级全充满是稳定状态,故由小到大的前三种元素是Li<B<Be。
(2)硅原子最外层有4个电子,乙硅烯、丙硅烯分子中,均有硅原子形成了3个σ键,故二者分子中均有硅原子为sp2 杂化。甲硅烷分子中硅为sp3杂化,是正四面体结构。原子半径Si>C,Si-Si长度大于C-C,键能较小,键的稳定性较差,不利于形成长链。硅烷同系物组成、结构相似,随着分子中硅原子数目的增加,熔、沸点升高。
(3)观察晶胞图知,顶点A紧邻等距离最近的X位于晶胞的三个平面,即横平面、正平面和侧平面,将每个平面扩展,则每个平面中距离A最近的X均有4个,故共有3×4=12个。M位于体心,故其坐标为(![]() ,
,![]() ,
,![]() )。根据均摊原理知,X是氧,一个晶胞中含有一个“CaTiO3”,晶胞的体积是1×10-30r3cm3,由此可求出其密度为
)。根据均摊原理知,X是氧,一个晶胞中含有一个“CaTiO3”,晶胞的体积是1×10-30r3cm3,由此可求出其密度为![]() g/cm3。
g/cm3。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】常温下,现有浓度都为0.1mol·L-1HA、HB的溶液各20mL,分别用0.1mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。下列判断错误的是
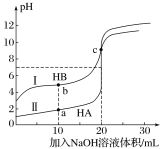
A. 滴定过程中,水电离的c(H+)·c(OH-)均不变
B. 相同条件下,HB的电离程度小于HA的电离程度
C. V=10mL时,c(HB)+c(B-)=2c(Na+)
D. V=20mL时,c(A-)>c(B-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国工业废水中几种污染物即其最高允许排放浓度如下表。下列说法不正确的是
污染物 | 汞 | 镉 | 铬 | 铅 | 砷 | 氰化物 |
主要存在形式 |
|
|
|
|
|
|
最高允许排放浓度
|
|
|
|
|
|
|
注:我国规定酸、碱废水pH的最大允许排放标准是大于6、小于![]()
A.![]() 、
、![]() 、
、![]() 是重金属离子
是重金属离子
B.对于![]() 的废水可用中和法处理
的废水可用中和法处理
C.将![]() 转化为
转化为![]() 是用氧化还原的方法
是用氧化还原的方法
D.在含有![]() 的废水中加入
的废水中加入![]() ,可使转变为沉淀而除去
,可使转变为沉淀而除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列有关叙述正确的是( )
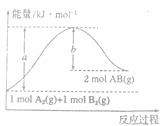
A.每生成2molAB(g)吸收bkJ热量
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=+(a-b)kJ/mol
D.形成1molA-A键和1mo1B-B键,吸收akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲增加Mg(OH)2在水中的溶解,可采用的方法是 ( )
A.增加溶液pHB.加入2.0mol/L NH4Cl
C.加入0.1mol/L MgSO4D.加入适量95%乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
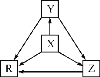
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是( )
A.pH=2的溶液中可能大量存在Na+、![]() 、
、![]()
B.某无色溶液中可能大量存在H+、Cl-、![]()
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸与Ba(OH)2溶液的反应:H++![]() +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com