
分析 ①碳酸氢钠的化学式是NaHCO3,碳酸氢钠俗称不苏打;
②因NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,由此分书写离子方程式;而胃溃疡患者则不能服用它来治疗胃酸过多,可用Al(OH)3代替;
③根据杂质碳酸氢钠不稳定性除去.
解答 解:①碳酸氢钠的化学式是NaHCO3,碳酸氢钠俗称不苏打,故答案为:NaHCO3,小苏打;
②因NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,则反应的离子方程式为HCO3-+H+=H2O+CO2↑,而胃溃疡患者则不能服用它来治疗胃酸过多,可用Al(OH)3代替,故答案为:HCO3-+H+=H2O+CO2↑;Al(OH)3;
③除去碳酸钠固体中碳酸氢钠的方法为加热,方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
点评 本题综合考查了Na2CO3和NaHCO3的性质,侧重于学生的分析能力和元素化合物知识的综合运用的考查,试题内容简单,只要掌握基础知识就可完成.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
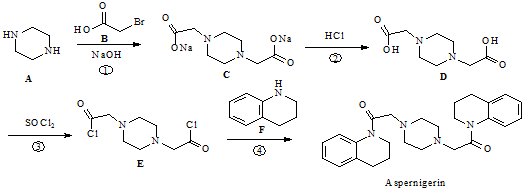
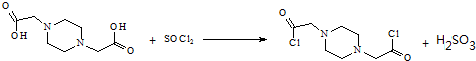 .
.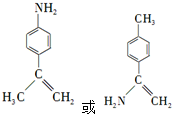 .
.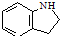 为原料,利用上述有关信息,写出制备
为原料,利用上述有关信息,写出制备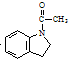 的合成路线流程图(无机试剂任用).合成路线流程图例如下:CH2═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图例如下:CH2═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛和乙酸乙酯 | B. | 甲酸和乙酸 | ||
| C. | 甲醛和乙醇 | D. | 甲酸甲酯和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
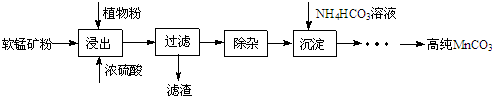
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 作为测量中和反应反应热的装置图,从玻璃仪器的角度看,图1还缺少环形玻璃搅拌棒 | |
| B. | 检验图2装置的气密性时,向漏斗中加水若出现图中所示的现象,可以证明该气密性良好 | |
| C. | 已知图3是利用原电池检验空气中Cl2含量的装置,其中Pt电极作负极 | |
| D. | 根据图4的溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com