
分析 根据pH值计算各溶液中氢离子浓度,再根据n=cV计算氢离子物质的量,混合后溶液中氢离子物质的量为二者之和,再根据c=$\frac{n}{V}$计算混合后氢离子浓度,根据pH=-lgc(H+)计算.
解答 解:pH=2的H2SO4溶液中c(H+)=0.01mol/L,PH=4的H2SO4溶液中c(H+)=10-4mol/L,等体积混合后溶液中c(H+)=$\frac{1}{2}$(0.01mol/L+10-4mol/L)≈$\frac{1}{2}$×0.01mol/L,混合或pH=-lg($\frac{1}{2}$×0.01)=2.3,
答:混合后溶液的pH约是2.3.
点评 本题考查溶液pH的简单计算,关键是对溶液pH的理解,注意忽略计算,掌握等体积混合后pH规律.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
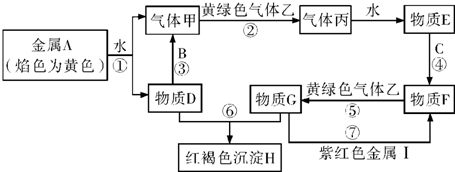
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
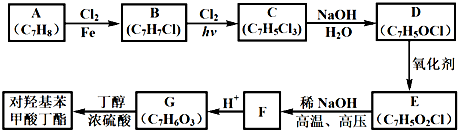
 .
.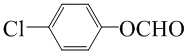 (写一种结构简式)
(写一种结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的电离:H3PO4?3H++PO43- | |
| B. | 甲烷的燃烧为-890.3KJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| C. | 实验室制取氢氧化铁胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用双氧水处理含NaCN的碱性废水:2CN-+5H2O2+2OH-═2CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
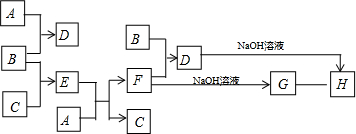
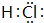 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com