
| A. | 亚硫酸溶液中含有亚硫酸、水、二氧化硫三种分子 | |
| B. | 用浓盐酸酸化高锰酸钾溶液,可增强高锰酸钾的氧化能力 | |
| C. | 铵盐受热都易分解,生成氨和相应的酸 | |
| D. | SiO2是酸性氧化物,能与氢氧化钠溶液反应,不与任何酸反应 |
分析 A、亚硫酸是弱电解质,在水溶液里部分电离;
B、高锰酸钾能氧化浓盐酸;
C、铵盐受热易分解,但是不一定得到氨气;
D、二氧化硅可以和HF之间反应.
解答 解:A、亚硫酸是弱电解质,在水溶液里部分电离,SO2+H2O?H2SO3?H++HSO3-所以溶液中存在亚硫酸、水、二氧化硫三种分子,故A正确;
B、高锰酸钾具有强氧化性、浓盐酸具有还原性,二者能发生氧化还原反应而生成氯气,故B错误;
C、铵盐受热易分解,但是不一定得到氨气和相应的酸,故C错误;
D、二氧化硅是酸性氧化物,可以和碱、碱性物质之间反应,并且还可以和酸HF之间反应,故D错误.
故选A.
点评 本题考查了物质的性质,涉及弱电解质、氧化还原反应、铵盐以及二氧化硅的性质考查,根据这些物质的性质分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用酒精清洗银器表面的氧化膜 | |
| C. | 用米汤检验含碘盐中的碘酸钾(KIO3) | |
| D. | 用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③⑤⑥ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
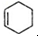 ,化合物A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于化合物A的一种制备方法及由A引发的一系列化学反应.
,化合物A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于化合物A的一种制备方法及由A引发的一系列化学反应.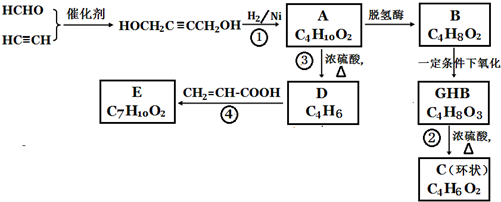
 +H2O.
+H2O.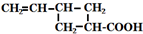 外,还有(写出结构简式)
外,还有(写出结构简式)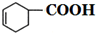 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用重结晶法可除去KNO3晶体中混有少量NaCl晶体 | |
| B. | 实验室制取乙酸丁酯时用水浴加热 | |
| C. | 在硫酸钡悬浊液中加入足量饱和碳酸钠溶液可将其转化为碳酸钡 | |
| D. | 二氧化硫分别通入到硫化钠和硝酸钡溶液中产生沉淀可证明二氧化硫的氧化性和还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol•L-1NaOH溶液中 | |
| B. | 比较氯、溴非金属性:氯气通入溴化钠溶液中 | |
| C. | 比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 | |
| D. | 比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单地说,金属的冶炼就是把金属单质从其矿物中分离出来 | |
| B. | 金属冶炼过程中,被冶炼的金属只能被氧化 | |
| C. | 金属冶炼过程中,被冶炼的金属只能被还原 | |
| D. | 金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
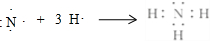
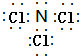
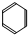 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com