
| A、氧化还原反应中,金属元素被还原一定得到金属单质 |
| B、Ag++Cl-=AgCl↓的反应属于化合反应 |
| C、一种元素化合价升高时必然有另一种元素化合价降低 |
| D、从0.1L0.1mol/L的H2SO4溶液中取出10mL该溶液,其中H+浓度为0.2mol/L |


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、①③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的颜色逐渐变浅 |
| B、平衡向正反应方向移动 |
| C、溶液由浅绿色变成黄色 |
| D、平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
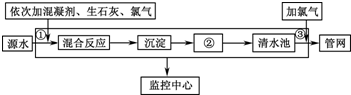 如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R2+>X2+>Z2+>Y2+ |
| B、X2+>R2+>Y2+>Z2+ |
| C、Y2+>Z2+>R2+>X2+ |
| D、Z2+>X2+>R2+>Y2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究确定六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途.下列推测正确的是( )
研究确定六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途.下列推测正确的是( )| A、SF6中各原子均达到8电子稳定结构 |
| B、SF6分子中既含有非极性共价键键又含有极性共价键 |
| C、SF6分子是含有极性键的非极性分子 |
| D、SF6可能是原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③ |
| C、③④ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积比为8:11 |
| B、分子个数之比为11:12 |
| C、物质的量之比为8:11 |
| D、原子个数之比为11:12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com