
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有3种含氯元素的离子,其中ClO-和ClO![]() 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
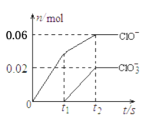
A.苛性钾中KOH的物质的量为0.24mol
B.反应中转移电子的物质的量是0.21mol
C.有2.688L氯气参与反应
D.酸性条件下ClO-和ClO![]() 可生成Cl2
可生成Cl2
【答案】A
【解析】
由信息可知,氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象可知完全反应时溶液中n(ClO-)=0.06mol、n(ClO3-)=0.02mol,根据得失电子数目守恒可知反应生成的氯离子n(Cl-)=0.06mol×(1-0)+0.02mol×(5-0)=0.16mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.16mol+0.06mol+0.02mol=0.24mol。
A.由分析可知,溶液中n(K+)=0.24mol,由钾原子个数守恒可知,苛性钾中KOH的物质的量为0.24mol,故A正确;
B.根据图象可知完全反应时溶液中n(ClO-)=0.06mol、n(ClO3-)=0.02mol,反应中转移电子的物质的量是0.06mol×(1-0)+0.02mol×(5-0)=0.16mol,故B错误;
C.由分析可知,溶液中n(ClO-)=0.06mol、n(ClO3-)=0.02mol、n(Cl-)=0.16mol,由物料守恒可知参加反应的氯气的物质的量为![]() =0.12mol,标准状况下体积为0.12mol ×22.4L/mol=2.688L,因没有明确是否为标准状况,则无法计算0.12mol氯气体积,故C错误;
=0.12mol,标准状况下体积为0.12mol ×22.4L/mol=2.688L,因没有明确是否为标准状况,则无法计算0.12mol氯气体积,故C错误;
D.ClO-和ClO![]() 中氯元素化合价都大于0,按照氧化还原反应规律,两者不可能发生氧化还原反应生成氯气,故D错误;
中氯元素化合价都大于0,按照氧化还原反应规律,两者不可能发生氧化还原反应生成氯气,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】向Cu和CuO的混合物中加入0.6 L 2.0 mol/L的稀硝酸,混合物完全溶解,同时生成标准状况下NO 4.48 L。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,将沉淀洗涤,充分灼烧后得32.0 g固体。求:
(1)混合物中Cu的质量是____________。
(2)混合物消耗HNO3的物质的量是____________。
(3)NaOH溶液的体积是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下:(废料中的其他金属含量较低,对实验影响可忽略)
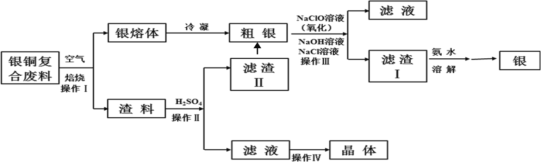
已知:①AgCl可溶于氨水,生成[Ag(NH3)2]+;
②Ksp(Ag2SO4)=1.2×105,Ksp(AgCl)=1.8×1010;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取_______措施(写出其中一种即可)。
(2)操作IV经过________、_______过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是__________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为______(其中AgCl和NaCl的物质的量之比为2∶1)。氧化的同时发生沉淀转化,离子方程式为_____,其平衡常数K=__________。
(5)在空气中加热5.20g硫酸铜晶体(CuSO4·5H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。(已知CuSO4·5H2O相对分子质量250)
温度范围/℃ | 固体质量/g |
200~260 | 3.33 |
650~800 | 1.67 |
1000~1500 | 1.50 |
加热到1000℃时,固体物质的化学式为:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应。常温下,金属D单质投入水中能与水剧烈反应。常温下E单质是常见的气体。请按要求回答下列几个问题:
(1)B、D的元素名称分别为:________、________。
(2)E在周期表中的位置为:________。
(3)C离子的结构示意图为:________。
(4)B、C、D三种元素的原子半径从大到小的顺序为________(用元素符号表示)。
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:________(用对应的化学式表示)。
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为20 mL、浓度均为0.1mol/L的两种酸HX、HY分别与0.1mol/L的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
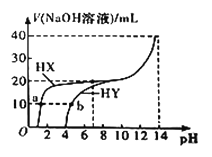
A. 加入10 mL NaOH溶液时,a点c(X)<b点c(Y)
B. HY中加NaOH溶液至pH=7时,所得溶液中c(Y)=c(Na+)=c(OH)=c(H+)
C. b点溶液中,c(Y)+2c(OH)=c(HY)+2c(H+)
D. 25℃时,HX为强酸,HY为弱酸且Ka=108
查看答案和解析>>
科目:高中化学 来源: 题型:
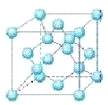
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-丁烯是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2-丁烯与氢气反应的化学方程式为____________,反应类型为______。
(2)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为_________;A分子中能够共平面的碳原子个数为________,A与溴的四氯化碳溶液反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol MnO2和50mL 12mol·L-1盐酸混合后缓慢加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀,物质的量为x mol(不考虑盐酸的挥发),则x的取值范围是
A.x=0.3B.x<0.3C.0.3<x<0.6D.以上结论都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法错误的是( )
A.标准状况下,11.2L甲烷含氢原子数目为2NA
B.100g 46%的乙醇溶液中,含氧原子的数目为NA
C.14 g乙烯和丙烯混合气体中的氢原子数为2NA
D.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com