
| A. | 过氧化钠可用作呼吸面具中的供氧剂 | |
| B. | 向海水中加净水剂明矾可使海水淡化 | |
| C. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| D. | 服用抗氧剂维生素C有利于人体对铁元素的吸收 |
分析 A.过氧化钠与水、二氧化碳反应都产生氧气;
B.明矾水解生成氢氧化铝胶体,可除去水中的悬浮物;
C.原电池能加快化学反应的速率;
D.维生素具有还原性,能够还原三价铁离子.
解答 解:A.过氧化钠与二氧化碳或水反应生成氧气,则过氧化钠可用作潜艇供氧剂,故A正确;
B.明矾水解生成氢氧化铝胶体,可除去水中的悬浮物,不能除去可溶性盐类,不能使海水淡化,故B错误;
C.氯化钙是电解质,能与桥梁中的钢构成原电池,故C正确;
D.维生素具有还原性,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁元素的吸收,故D正确;
故选:B.
点评 本题考查了物质的用途,熟悉过氧化钠、明矾、维生素性质,明确金属电化学腐蚀原理是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
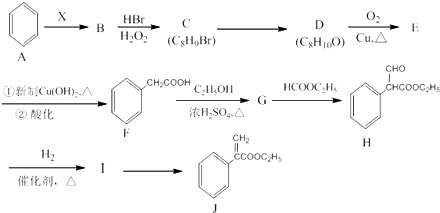
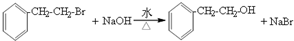 .
.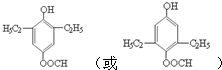 (任写一种即可).
(任写一种即可).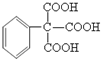 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).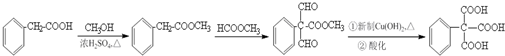 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
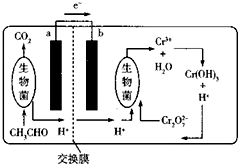 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )| A. | b极为正极,发生还原反应 | |
| B. | 负极的电极反应式为CH3CHO-10e-+3H2O═2CO2↑+10H+ | |
| C. | 理论上处理l mol Cr2O72-时有l4mool H+从交换膜左侧向右侧迁移 | |
| D. | 放电时,交换膜右侧生物菌周围溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
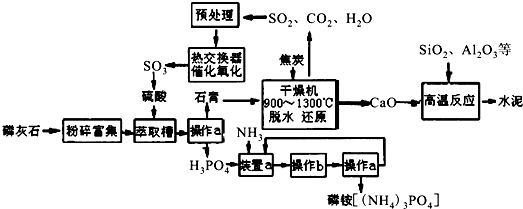
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当滴入20mL NaOH溶液时:c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| D. | 当滴入30mL NaOH溶液时,所得溶液pH>7:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(I-)=0.1mol•L-1的溶液中:Na+、Mg2+、ClO-、SO42- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Fe2+、Na+、NO3-、Cl- | |
| D. | 由水电离产生的c(OH-)=1×10-10 mol•L-1的溶液中:Ba2+、K+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
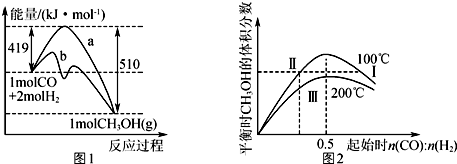
| A. | 正反应的△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) | |
| C. | 平衡时CO的转化率:α(CO,状态Ⅰ)<α(CO,状态Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,1 00℃)<c(CH3OH,200℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
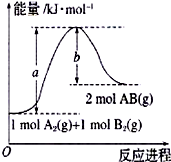 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 通入过量的O2可以使SO2转化率达到100% | |
| C. | 升高温度可以增大反应速率 | |
| D. | 增大O2浓度可以增大反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com