
| A��I2�ڷ�Ӧ�����ǻ�ԭ����ڷ�Ӧ�������������� |
| B��������Ӧ�����ɵ�����I2ʱת�Ƶĵ�������� |
| C��NaI��NaIO3��һ���������ܷ�Ӧ����I2 |
| D��NaIO3�ڻ�ѧ��Ӧ��ֻ������������������ԭ�� |
 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��CO2��ˮ��Һ�����ԣ� H2CO3  2H++CO32- 2H++CO32- |
B������ʽ��ʾ�Ȼ��������γɹ��̣�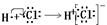 |
| C��AlCl3��Һ�м��������ˮ��Al3++4NH3?H2O =AlO2-+ 4NH4++2H2O |
| D����K2Cr2O7��Һ�еμ�����ŨH2SO4����Һ��ɫ��� |
 2CrO42��(��ɫ) +2H+
2CrO42��(��ɫ) +2H+�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 HCOONa+H2O�������й�˵������ȷ����( )
HCOONa+H2O�������й�˵������ȷ����( ) | A�����⡢������̾��������仯 |
| B��NaHCO3��HCOONa���������Ӽ����ۼ� |
| C����������У�NaHCO3����ԭ |
| D����������У�ÿ����0.1mol H2O�ų�2.24L��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
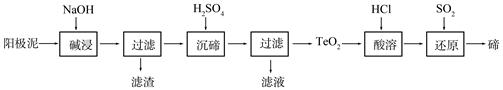
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
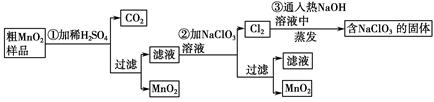
 ��
�� ClO3����
ClO3���� =
= MnO2����
MnO2���� Cl2����
Cl2���� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��11.2L NO��11.2L O2��Ϻ�ķ�������ΪNA |
| B��1mol����ϩ�к��е�̼̼˫����Ϊ4NA |
| C��50mL 18.4mol/LŨ����������ͭ�ȷ�Ӧ������SO2������ĿΪ0.46NA |
| D��1mol Fe��������ϡHNO3��Ӧ���ų�NO��N2O��ת��3 NA������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2KMnO4��16HCl(Ũ)��2KCl��2MnCl2��5Cl2����8H2O |
| B��Zn��2HCl��ZnCl2��H2�� |
| C��NaOH��HCl��NaCl��H2O |
| D��CuO��2HCl��CuCl2��H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A���������ױ��Ľṹ��ʽ��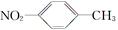 |
B��CH2F2�ĵ���ʽ��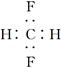 |
| C��16O2��18O2��Ϊͬ�������� |
| D����Ȳ�����ʽ��CH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
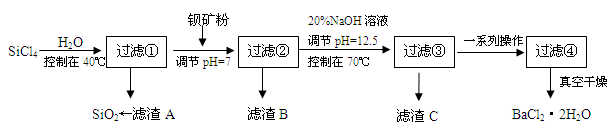
 ��Һ��
��Һ�� ��Һ�����ԣ�������ƽ��ԭ���ͱ�Ҫ�����ֽ�������C������3mol/L��
��Һ�����ԣ�������ƽ��ԭ���ͱ�Ҫ�����ֽ�������C������3mol/L�� ��Һ��ԭ��______��
��Һ��ԭ��______���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com