
 .
. 分析 (1)海水淡化海水就是将海水中的可溶性杂质除去的过程,可根据淡化原理进行分析解答;
目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,其中最常用的是蒸馏法,据此解答;
(2)葡萄糖为多羟基醛,含有5个羟基一个醛基;
(3)火法炼铜原理为:高温下将硫化亚铜与氧气反应生成二氧化硫和铜;
(4)CH3CH=CH2在催化剂条件下生成聚丙烯,据此书写方程式.
解答 解:(1)解:目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,其中最常用的是蒸馏法;
故答案为:蒸馏法、冰冻法、电渗析法、离子交换法、太阳能蒸发法;
(2)葡萄糖为多羟基醛,含有5个羟基一个醛基,结构简式为:CH2OH(CHOH ) 4CHO;
故答案为:CH2OH(CHOH ) 4CHO;
(3)火法炼铜原理为:高温下将硫化亚铜与氧气反应生成二氧化硫和铜,方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2;
故答案为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2;
(4)CH3CH=CH2在催化剂条件下生成聚丙烯,反应方程式: ;
;
故答案为: .
.
点评 本题考查了物质结构简式、化学方程式的书写,明确有机物结构是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素等高分子化合物均属于纯净物 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | |
| D. | 丁达尔效应可用于区别溶液与胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g CH4中含有的原子总数为5NA | |
| B. | 78g苯含有碳碳双键的数目为3NA | |
| C. | 1mol/L NaCl溶液中含有的氯离子数目为NA | |
| D. | 标准状态下,11.2L CH3COOH中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 水分子间存在π键 | B. | 水分子间存在氢键 | ||
| C. | 水分子是V形结构 | D. | 水分子是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
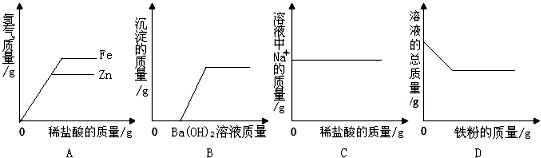
| A. | 将等质量的锌片和铁片分别加入足量的等质量等质量分数的稀盐酸中 | |
| B. | 向盐酸与硫酸钠混合溶液中加入氢氧化钡溶液 | |
| C. | 向一定量的氢氧化钠溶液中滴加稀盐酸 | |
| D. | 向一定量的硫酸铜溶液中加入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期主族元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 1/3 | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com