
【题目】根据如图转化关系以及实验现象填写空白.
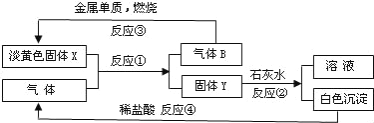
(1)固体X是________(填化学式)。
(2)反应①的化学方程式是__________________________________。
(3)反应④的离子方程式是_________________________________。
(4)图中溶液的溶质是____________(填化学式),现有100mL含浓度均为1.0mol/L的MgCl2和AlCl3的混合溶液,要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要2.0mol/L该溶液的体积为___________mL。
【答案】 Na2O2 2Na2O2+2CO2=2Na2CO3+O2 CaCO3+2H+=Ca2++CO2↑+H2O NaOH 300
【解析】根据图中信息可知,淡黄色固体为金属与气体反应而得,故X为过氧化钠,气体B为氧气,金属单质为钠,过氧化钠与气体CO2反应生成气体B和固体Y为碳酸钠,碳酸钠与石灰水反应生成白色沉淀碳酸钙和溶液氢氧化钠,白色沉淀与盐酸反应生成二氧化碳。(1)固体X是Na2O2;(2)反应①是过氧化钠与二氧化碳反应生成碳酸钠和氧气,其化学方程式是:2Na2O2+2CO2=2Na2CO3+O2;(3)反应④是碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,其离子方程式是CaCO3+2H+=Ca2++CO2↑+H2O;
(4)根据图中信息,图中溶液的溶质是NaOH,要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,则加入的NaOH将Mg2+转化为沉淀而将Al3+转化为偏铝酸盐,即有关的方程式是Al3++4OH-=AlO2-+2H2O、Mg2++2OH-=Mg(OH)2↓。Mg2+和Al3+的物质的量均为0.10mol,所以根据方程式可知,至少消耗NaOH的物质的量是0.10mol×4+0.10mol×2=0.60mol,所以需要2.0mol/L NaOH溶液的体积是![]() =0.30L=300mL。
=0.30L=300mL。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 NH3·H2O溶液中存在如下电离平衡:NH3·H2O![]() NH4+ + OH- 。对于该平衡,下列叙述中正确的是
NH4+ + OH- 。对于该平衡,下列叙述中正确的是
A.加入水时,溶液中c(OH-) / c(NH3·H2O) 增大
B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大
D.降低温度,溶液中c(NH4+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,据此判断,氯化铝是(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断合理的是( )
A. 明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B. 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C. 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D. 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X原子的最外层有6个电子,元素Y原子的最外层有3个电子,这两种元素形成的化合物的化学式可能是( )
A.X3Y2
B.X2Y
C.Y3X2
D.Y2X3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,2L 0.5 mol·L-1的KNO3溶液含有
A. 0.5mol的K+ B. 3.0mol的O2
C. 1.0mol的NO3- D. 1.0mol的OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com