
分析 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3中Cl元素的化合价由+5价降低为0,HCl中Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:(1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
故答案为:
(2)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,HCl中Cl元素的化合价由-1价升高为0,失去电子被氧化,HCl作还原剂,对应的氯气为氧化产物;
KClO3中Cl元素的化合价由+5价降低为0,得到电子被还原,对应还原产物,氯气既是氧化产物又是还原产物,
故答案为:HCl;Cl2;
(3)反应中6molHCl参加反应,只有5mol被氧化,所以,若有1molHCl完全反应,则转移的电子得到物质的量是$\frac{5}{6}$,故答案为:$\frac{5}{6}$.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意从元素化合价的角度分析,能用双线桥标出电子转移的方向和数目,难度不大.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸保存在带有橡胶塞的细口瓶中 | |
| B. | 金属钠保存在装有煤油的试剂瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 液溴保存时需加水形成水封 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
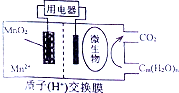
| A. | MnO2极为负极 | |
| B. | Cn(H2O)m发生了氧化反应 | |
| C. | 电子从负极区经交换膜移向正极区 | |
| D. | 放电过程中,H+从正极区移向负极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、CO32-、Cl- | B. | Ca2+、K+、CO32-、OH- | ||
| C. | Fe3+、Ba2+、NO3-、SO42- | D. | H+、Na+、Cu2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | CuO | C. | Cu(OH)2 | D. | Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 N2H+5+OH-,25℃时水溶液中肼与强酸反应结合一个质子的平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$.常温下,若将2mol/LN2H4•H20溶液与1.3mol/L硫酸溶液等体积混合,则溶液中各微粒(离子及N2H4•H2O)浓度由大到小的顺序为c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-).
N2H+5+OH-,25℃时水溶液中肼与强酸反应结合一个质子的平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$.常温下,若将2mol/LN2H4•H20溶液与1.3mol/L硫酸溶液等体积混合,则溶液中各微粒(离子及N2H4•H2O)浓度由大到小的顺序为c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 升高温度 | D. | 加入少量氢氧化钠固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com