
20 ℃时向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH溶液,溶液pH变化如图所示。此过程中离子浓度的关系错误的是( )
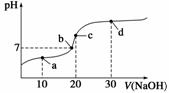
A.a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.c点:c(H+)=c(CH3COOH)+c(OH-)
D.d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
科目:高中化学 来源: 题型:
A、B、C三个电解池,A池内盛有CuCl2溶液,纯铜片作阴极,B与C两池内均盛有AgNO3溶液,纯银丝作阴极。当B池中银丝质量增加0.108 g、C池中银丝质量增加0.216 g时,A池中铜片质量增加( )
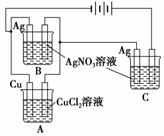
A.0.216 g B.0.108 g
C.0.064 g D.0.032 g
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)吸收液吸收SO2的过程中,pH随n(SO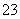 )∶n(HSO
)∶n(HSO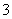 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:________________________________________________________________________。
(2)当吸收液的pH降至约为6时,需送到电解槽再生。再生示意图如下:
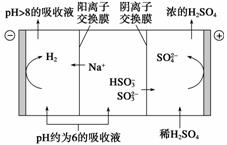
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O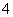 )
)
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中各微粒的浓度关系正确的是(双选)( )
A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH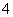 )=c(K+)=2c(Ba2+)
)=c(K+)=2c(Ba2+)
B.将10 mL 0.1 mol·L-1 Na2CO3溶液逐滴滴入10 mL 0.1 mol·L-1盐酸中:c(Na+)>
c(Cl-)>c(HCO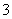 )>c(CO
)>c(CO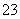 )
)
C.向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH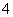 )+c(Na+)=c(HCO
)+c(Na+)=c(HCO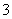 )+c(CO
)+c(CO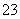 )
)
D.0.2 mol·L-1某一元弱酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为______________,为何此种情况能测出NaOH的含量?________________。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?________________________________________________________________________,
请说明理由:__________________________________________________________________。
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合

溶液稀释至250 mL,然后用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O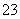 ===2I-+S4O
===2I-+S4O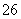 )。取用Na2S2O3的标准溶液应该用________式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
)。取用Na2S2O3的标准溶液应该用________式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
| 滴定次数 | 待测液的 体积(mL) | 滴定前的 读数(mL) | 滴定后的 读数(mL) |
| 第一次 | 25.00 | 0.00 | V=________ |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________,下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生产、生活密切相关。下列说法正确的是( )
A.石英只能用于生产光导纤维
B.从海水中提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,现有0.1 mol·L-1的氨水。请回答下列问题:
(1)为了证明一水合氨(NH3·H2O)是弱电解质,常温下,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液,NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
①甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“是”或“否”),请说明理由:__________________________________________________________
__________________________________________________________。
②乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测出pH为b,若要确认NH3·H2O是弱电解质,则a、b应满足关系:________________(用等式或不等式表示)。
③丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试剂,显粉红色,再加入少量NH4Cl晶体,颜色变________(填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质?________(填“能”或“否”),并说明原因:__________________________________________________________
__________________________________________________________。
(2)若向氨水中加入少量硫酸铵固体,此时溶液中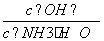 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(3)若向氨水中加入稀硫酸,二者恰好完全反应后所得溶液的pH________7(填“>”、“<”或“=”),用离子方程式解释原因:__________________________________________________________
__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物的俗称与化学式不对应的是( )
A.绿矾-FeSO4·7H2O
B.芒硝-Na2SO4·10H2O
C.明矾- Al2(SO4)3·12H2O
D.胆矾- CuSO4·5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com