
X衍射实验测得,金属银属于立方晶系,它的晶胞参数a = 408 pm;又用比重瓶测出金属银的密度d = 10.6 g/cm3。问金属银的点阵类型。
分析:欲得一个晶胞里有几个银原子,需得知一个晶胞的质量。后者可根据晶胞的体积和金属的密度求得。
求出Z = ?,对于常见的金属晶胞,就可以获知它的点阵类型。一般规律是:Z = 1,简单立方;Z = 2,六方密堆积的六方晶胞或体心立方(金属晶体很少有底心类型,一般可排除);Z = 4,面心立方。(注:根据较深入的理论,从X衍射实验得到的衍射图谱上考察衍射强度就可确定点阵的带心与否以及带心类型,从略。)
解:
晶胞体积 V = (408pm)3
晶胞的质量 m = 10.6g / cm3 ×(4.08×10-8cm)3
设晶胞含有 x个银原子,质量为x107.9 / 6.022×1023
x107.96g / 6.022×1023 = 10.6g/cm3 × (4.08×10-8cm)3
∴ x = 4.02
所以,一个晶胞含4个银原子(注:由于数据来自测定实验,不可能得到4.0000的整数,而原子数总是整数。
因此,银的点阵类型属于面心立方点阵。


科目:高中化学 来源:2013-2014学年陕西省等五校高三第二次联考理综化学试卷(解析版) 题型:填空题
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
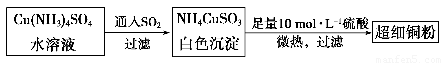
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为_______________________(填元素符号)。
②SO42-的空间构型为________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因______________________;在该晶体中存在的化学键的种类有_____________。
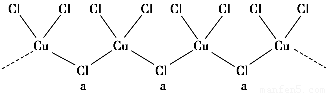
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。
用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,阿伏加德罗常数的值为________[已知Ar(Cu)=63.6]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com