
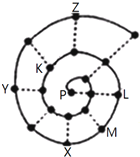
 如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )
如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )| A. | Y元素对应的氢化物比Z元素对应的氢化物更稳定 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | M、K元素的离子半径大小顺序是M2+>K2- | |
| D. | 由K、L两种元素组成的化合物中不可能含有共价键 |
分析 P点代表氢元素,按照原子序数由小到大由里往外延伸,可以确定各黑点对应的元素,根据元素的种类可知虚线相连的元素处于同一族,P、L连线的三元素为第ⅠA族,P为H元素,K为O元素,L为Na元素,M为Mg元素,X为Al元素,Y为P元素,Z为Cl元素,结合对应元素的性质解答该题.
解答 解:A.Y为P元素,Z为Cl元素,元素的非金属性越强,其氢化物越稳定,则Z元素对应的氢化物比Y元素对应的氢化物更稳定,故A错误;
B.由原子序数可知,虚线相连的元素处于同一族,故B正确;
C.K为O元素,M为Mg元素,电子排布相同的离子,原子序数越大,离子半径越小,所以离子半径大小顺序是O2->Mg2+,故C错误;
D.K为O元素,L为Na元素,二者形成的离子化合物过氧化钠中存在非极性共价键,故D错误,
故选B.
点评 本题考查元素周期表、元素周期律等,难度不大,看懂图象推断元素是解题的关键,注意对元素周期表的整体把握,侧重于考查学生的分析能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
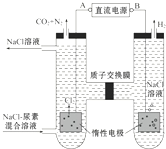
| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:
(1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )
天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )| A. | 氧化剂 | B. | 还原剂 | C. | 强酸 | D. | 强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用洁淨铂丝蘸取少量待测液在酒精灯火焰上灼烧 | 火焰呈现黄色 | 待测液中只含Na+,不含K+ |
| B | 用铁作电极电解饱和食盐水 | 两极上均产生气体 | 阴、阳极分别生成H2和Cl2 |
| C | 向饱和氯水中加人少量石灰石 | 产生无色气体 | 酸性:HCl0>H2CO3 |
| D | 向Ca(ClO)2溶液中 通入足SO2 | 产生白色沉淀 | Ca(C1O)2具有氧化性,沉淀为CaSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某学校研究性学习小组开展课题探究:
某学校研究性学习小组开展课题探究:| 组别 | 草酸的体积(mL) | 温度/℃ | 其他物质 |
| ?① | 2mL | 20 | |
| ?② | 2mL | 20 | 10滴饱和MnSO4溶液 |
| ?③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O是还原剂 | B. | Fe被氧化 | C. | H2O发生氧化反应 | D. | Fe得到电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com